Anteriormente à aplicação clínica do Doppler, a ecocardiografia se limitava a uma descrição qualitativa das anormalidades valvares. A maioria dos pacientes com doença valvar cardíaca grave era submetida a cateterismo cardíaco antes da intervenção cirúrgica. O Doppler, entretanto, mudou o papel da ecocardiografia na avaliação da doença valvar. Os gradientes de pressão, o débito cardíaco, a área estenótica valvar, a fração regurgitante e a gravidade da insuficiência valvar são agora determinados de modo confiável pela ecocardiografia Doppler através da imagem do fluxo a cores. Na maior parte dos pacientes com doença cardíaca valvar, a avaliação ecocardiográfica deve ser capaz de permitir a obtenção de dados abrangentes a respeito do tamanho do ventrículo esquerdo e de sua função sistólica global, da morfologia valvar, da hemodinâmica valvar e das pressões pulmonares. Com base nesta informação, juntamente com a história clínica do paciente e seu exame físico, os clínicos podem determinar a melhor estratégia de tratamento, incluindo a intervenção cirúrgica. Neste capítulo, a avaliação ecocardiográfica abrangente das doenças valvares cardíacas é discutida de forma seqüencial.
Avaliação da Estenose Valvar
Uma valva estenótica é geralmente espessada e calcificada, e sua abertura é restrita. Todas essas características podem ser visualizadas pela ecocardiografia bidimensional. Um exame ecocardiográfico bidimensional é útil na identificação da etiologia subjacente da estenose valvar, tal como a valva aórtica bicúspide, a doença reumática da valva mitral e a doença cardíaca carcinóide. A avaliação por ecocardiografia bidimensional, entretanto, é principalmente semi-quantitativa. Para que sejam obtidos dados hemodinâmicos, todos os pacientes com estenose valvar devem ser submetidos a um exame adequado por Doppler.
A velocidade de fluxo sangüíneo através de uma valva estenótica aumenta à medida que o orifício valvar se torna menor. A partir da velocidade Doppler (V), os gradientes de pressão transvalvares podem ser obtidos com base na equação de Bernoulli modificada (ver Cap. 5):
Gradiente de pressão = 4 X V2
Todas as janelas de transdutor disponíveis devem ser utilizadas para se ter certeza de que o feixe ultrasônico Doppler se encontra paralelo àdireção do jato estenótico. O transdutor Doppler de onda contínua sem imagem é menor e, portanto, mais fácil de ser manipulado entre as costelas e a goteira supra-esternal, comparado com um transdutor dúplex. Ocasionalmente, a imagem de fluxo a cores é útil em alinhar o feixe de Doppler contínuo paralelo à direção do jato de fluxo sangüíneo.
A precisão do gradiente de pressão obtido com o Doppler foi validada por dados obtidos no cateterismo cardíaco em estudo de correlação simultânea [1-3]. Deve ser enfatizado que, para uma determinada área valvar, a velocidade do fluxo, ou seja, o gradiente de pressão, irá variar com as alterações no débito cardíaco. Assim, o débito cardíaco deve ser levado em consideração na determinação da gravidade da estenose valvar. A equação de continuidade obtida pela mesma fórmula hidráulica básica sobre a qual a fórmula de Gorlin é baseada [4] pode estimar com precisão a área valvar pelo cálculo do volume ejetado a partir de outro orifício cardíaco. Uma excelente correlação entre os valores Doppler bidimensionais e a área da valva aórtica obtida por cateterismo tem sido descrita [5-9]. O pressure half-time (PHT), que é um intervalo de tempo necessário para o gradiente de pressão de pico atingir metade de seu valor inicial, é outro parâmetro Doppler útil para avaliar a gravidade da estenose mitral [10]. O índice de queda na pressão é mais lento na medida em que o orifício da mitral se torna menor; assim, o PHT é prolongado. Entretanto, o PHT pode subestimar de maneira falsa a gravidade da estenose mitral, uma vez que ele pode estar encurtado pela insuficiência aórtica concomitante (AR), pela diminuição da complacência ventricular ou imediatamente após valvuloplastia mitral com balão [11-14]. A avaliação das estenoses pulmonar e tricúspide utiliza métodos semelhantes àqueles descritos para as estenoses aórtica e mitral, respectivamente. Uma avaliação ecocardiográfica abrangente da estenose valvar individual se encontra ilustrada na seção seguinte.
Estenose Aórtica
Ecocardiografia Bidimensional e Modo-M
Uma valva aórtica normal tem cúspides delgadas, e uma abertura sistólica não-restritiva, como visto na Figura 7-1. A área valvar aórtica normal é de 3-4 CM² e a excursão de abertura normal geralmente produz uma separação de 2,0 cm dos folhetos (Fig. 7-1A). O mesmo grau de separação é mantido durante a maior parte da sístole, a não ser que o paciente tenha um baixo débito cardíaco (Fig. 7-1B) ou obstrução na via de saída do ventrículo esquerdo (LVOT). A fórmula mais comum de estenose valvar aórtica é devida à calcificação degenerativa. Assim, os folhetos estão espessados e a abertura das cúspides é reduzida (Fig. 7-2A). Ecos múltiplos na aorta ascendente são também um achado comum (Fig. 7-2B). Entretanto, um ecocardiograma modo-M pode ser aparentemente normal em pacientes com uma valva estenótica não calcificada com um doming sistólico, como na estenose aórtica congênita, uma vez que a restrição da abertura valvar ocorre na porção distal com doming. A ecocardiografia bidimensional visualiza toda a estrutura valvar aórtica e é útil para identificar tanto uma estenose aórtica não calcificada como também uma estenose calcificada (Fig. 7-3). Apesar de ser ocasionalmente difícil, o número de cúspides aórticas pode ser determinado pela ecocardiografia bidimensional, especialmente a partir da visão paraesternal de eixo curto ao nível da valva aórtica (Fig. 7-4). Além disso, o grau de calcificação valvar, o tamanho do anel aórtico e da aorta supravalvar ascendente e a presença de obstrução secundária subvalvar são facilmente avaliados. A ecocardiografia bidimensional é também útil em determinar o grau de hipertrofia do ventrículo esquerdo (espessamento da parede e sua massa), aumento do átrio esquerdo, função ventricular e integridade das outras valvas.
Ecocardiografia Doppler
A gravidade hemodinâmica da estenose aórtica determinada pelo Doppler baseia-se na velocidade aórtica de pico, no gradiente médio de pressão, na área da valva aórtica e no índice de integral velocidade-tempo entre a via de saída do ventrículo esquerdo-valva aórtica [5-9, 15]. Uma busca meticulosa para verificar toda a velocidade aórtica máxima éessencial, uma vez que todos os parâmetros acima são derivados a partir do pico da velocidade aórtica. Os métodos e as interpretações dos exames Doppler são discutidos de uma maneira gradativa.
Método
Passo 1. Obter a velocidade máxima de jato aórtico por busca sistemática, utilizando janelas múltiplas (Figs. 7-5 e 7-6).
Passo 2. Calcular o gradiente aórtico médio e a TVI, em busca do jato de velocidade máxima.
Passo 3. Determinar o volume ejetado e o débito cardíaco a partir do diâmetro da via de saída do ventrículo esquerdo e da velocidade (Fig. 7-7).
Passo 4. Calcular a área da valva aórtica utilizando a equação de continuidade (Figs. 7-8 e 7-9).
Ver também o Capítulo 5 para uma discussão detalhada da hemodinâmica Doppler.
Definição da Estenose Aórtica Grave
Quando a função sistólica do ventrículo esquerdo e o débito cardíaco são normais, a estenose aórtica grave é definida por:
1. Velocidade de pico da valva aórtica de 4,5 m/s ou maior (Fig. 7-10)
2. Um gradiente médio de pressão de 50 mmHg ou mais alto (Fig. 7-10)
3. Uma área de valva aórtica de 0,75 Cm² ou menor
4. Uma TVI de via da saída de ventrículo esquerdo/AV ou índice de velocidade de 0,2 ou menor (Fig. 7-11)
Quando a função sistólica do ventrículo esquerdo ou o débito cardíaco são alterados, deve-se considerar o seguinte: velocidade de pico e gradiente aórtico médio variam com mudanças no volume ejetado. Se a função do ventrículo esquerdo ou volume ejetado está diminuído, a velocidade aórtica de pico e o gradiente médio podem ser menores do que 4,5 m/s e 50 mm Hg, respectivamente, em pacientes com estenose aórtica grave. Entretanto, a velocidade ou índice TVI deve ser independente de qualquer mudança no volume ejetado, uma vez que as velocidades na via de saída do ventrículo esquerdo e na valva aórtica mudam proporcionalmente (ver Fig. 7-11). Na avaliação do baixo débito cardíaco (ou seja, baixo gradiente), o cálculo da área da valva aórtica pode indicar uma efetiva diminuição na área do orifício e subestimar a verdadeira gravidade da estenose aórtica. Uma infusão gradual de baixa dose de dobutamina (até 20 mg/kg/min) para aumentar o débito cardíaco pode ser útil em diferenciar morfologicamente a estenose aórtica grave da diminuição efetiva da área valvar devido a um baixo débito cardíaco (estenose aórtica pseudograve). Em pacientes com uma estenose aórtica verdadeiramente grave, a infusão de dobutamina irá aumentar a velocidade de pico e a TVI tanto na via de saída do ventrículo esquerdo como na valva aórtica, proporcionalmente (assim, o índice TVI LVOT/AV mantém-se o mesmo), enquanto um aumento na velocidade da TVI da via de saída do ventrículo esquerdo é muito maior do que na valva aórtica (cuja a área se torna maior com um maior débito; assim, o índice TVI LVOT/AV aumenta) em pacientes com estenose aórtica pseudograve. A dobutamina pode ser infundida gradualmente a partir de 5 mg/kg/min, em aumentos de 5 mg a cada 3 minutos, até que a velocidade na via de saída do ventrículo esquerdo ou a TVI atinjam um valor normal - 0,8 a 1,0/s ou 20 a 25 cm, respectivamente. O volume máximo ejetado é geralmente obtido com 15-20 mg/kg/min. Em pacientes com débito cardíaco aumentado (como na insuficiência aórtica ou na anemia) através da valva aórtica, a estenose aórtica pode não ser grave, mesmo quando a velocidade de pico é de 4,5 m/s ou maior, e o gradiente médio é de 50 mm Hg ou maior. Novamente, o índice de velocidade (ou TVI) LVOT/AV e a área da valva aórtica devem ser úteis em determinar a gravidade da estenose aórtica.
Para calcular a área da valva aórtica na presença de insuficiência aórtica significativa, devese considerar o seguinte. O fluxo através da valva aórtica aumenta com a insuficiência aórtica, assim como aumenta também o gradiente aórtico. Entretanto, o aumento é refletido nas velocidades da via de saída do ventrículo esquerdo e da valva aórtica, proporcionalmente, e seu índice TVI mantém-se o mesmo para uma determinada área da valva aórtica. O cateterismo cardíaco nesta situação não é confiável, tendendo a resultar em uma área menor da valva aórtica calculada, principalmente a uma subestimativa do débito cardíaco.
Problemas e Limitações
Os problemas e as limitações da ecocardiografia Doppler na avaliação da estenose aórtica são os seguintes:
1. O jato da estenose aórtica deve ser diferenciado de outros achados sistólicos ao Doppler (Fig, 7-12), incluindo a insuficiência mitral, a obstrução da via de saída do ventrículo esquerdo, a insuficiência tricúspide e a estenose pulmonar.
2. Pode ser difícil a mensuração do diâmetro da via de saída do ventrículo esquerdo devido a uma grande calcificação da valva aórtica e do seu anel, Nesta situação, o examinador deve utilizar outro orifício não-regurgitante (via de saída do ventrículo direito ou valva mitral) para calcular o volume sistólico. Neste caso, o índice TVI, e não o índice de velocidade de pico, deve ser utilizado, uma vez que os períodos de ejeção dos fluxos são diferentes.
3. Pode ser difícil a obtenção de uma velocidade satisfatória na via de saída no ventrículo esquerdo, devido a uma obstrução coexistente neste local, secundária a hipertrofia do septo basal.
4. Se o ritmo do paciente é outro que não o ritmo sinusal, as velocidades aórtica e da via de saída do ventrículo esquerdo irão variar a cada ciclo cardíaco, dependendo do intervalo R-R precedente. Neste caso, deve-se utilizar a velocidade média de 8 a 10 ciclos cardíacos, e/ou comparar os intervalos R-R para velocidades na via de saída do ventrículo esquerdo e na válvula aórtica, para se obter a TVI ou índice de velocidade (Fig. 7-13).
Implicações Clínicas
A ecocardiografia permite uma ampla avaliação dos pacientes com estenose aórtica e, com base nessa informação, decisões de tratamento precisas podem ser tomadas. Em pacientes com estenose aórtica grave (gradiente médio > 50 mm Hg e/ou área da valva aórtica > 0,75 Cm²), atualmente realizamos e recomendamos a substituição da valva aórtica com angiografia coronária prê-operatória, mas sem angiografia do ventrículo esquerdo ou determinação hemodinâmica invasiva.
Estenose Mitral
Ecocardiografia Bidimensional e Modo.M
Na maioria dos pacientes, a estenose mitral é causada por acometimento reumático da valva mitral. Os achados ecocardiográficos típicos bidimensionais e de modo-M incluem (Fig. 7-14)
1. Folhetos valvares mitrais espessados e espessamento, do aparelho subvalvar
2. Aparência de "bastão de hóquei" do folheto anterior da mitral na diástole (visão de eixo longo)
3. Orifício em "boca de peixe" na visão de eixo curto
4. Rampa E-F diminuída (modo-M)
5. Motilidade anterior do folheto mitral posterior (modo-M)
6. Aumento do tamanho do átrio esquerdo com um potencial para formação de trombos
A área da valva mitral pode ser medida por planimetria a partir da visão do eixo curto paraesternal (Fig. 7-14B). Isto pode ser difícil em pacientes com uma comissurotornia prévia ou calcificação acentuada. Em pacientes submetidos a valvuloplastia mitral por balão, o escore ecocardiográfico, baseado na espessura da valva e em sua calcificação, na mobilidade e no espessamento da parede subvalvar (Quadro 7-1), prevê o resultado do procedimento [16]. Pacientes com um escore ecocardiográfico de 8 ou menor têm um resultado mais favorável a partir da valvuloplastia mitral por balão do que pacientes com escore mais alto; contudo, um escore acima de 8 não impede a opção por valvuloplastia.
Imagem Doppler e de Fluxo a Cores
A ecocardiografia Doppler avalia vários parametros hemodinâmicos importantes para estimar a gravidade da estenose mitral [10, 17, 18]. Estes incluem o gradiente de pressão mitral, PHT, área da valva mitral, pressão da artéria pulmonar e regurgitação associada, À medida que a obstrução aumenta, não somente o gradiente de pressão aumenta, mas também o índice da queda de pressão se encontra prolongado.
Estimativa da Gravidade da Estenose Mitral
O método utilizado para estimar a gravidade da estenose mitral é o seguinte.
Passo 1. Determinar o gradiente de pressão pela obtenção da velocidade máxima utilizando o Doppler de onda contínua a partir das posições apical e paraapical (Fig. 7-15).
Passo 2. Obter o gradiente médio e a TVI (Figs. 7-16 e 7-17).
Passo 3. Calcular a área da valva mitral (MVA). Pelo método PHT.
MVA = 220/PHT
Pela equação de continuidade:
MVA = D2 LVOT x 0,785 x TVI LVOT/TVI MV
Passo 4. Determinar a pressão da artéria pulmonar pela utilização da velocidade de insuficiência tricúspide (ver Cap. 13).
Definição da Gravidade da Estenose Mitral
As seguintes categorias da gravidade da valva mitral são verificadas de acordo com a área valvar.
Normal: 4 a 6 cm²
Leve: 1,6 a 2,0 cm²
Moderada: 1,1 a 1,5 CM²
Grave: 1,0 CM² ou menor
A estenose mitral é considerada grave quando: (1) o gradiente médio de pressão é de 12 mmHg ou mais elevado, (2) a área da valva mitral é de 1,0 CM2 ou menor, e (3) o PHT é de 220 ms ou mais prolongado.
Resumindo, a área da valva mitral pode ser determinada diretamente pela planimetria na ecocardiografia bidimensional e pela equação de continuidade, ou indiretamente, pelo método PHT. Os três métodos devem ser utilizados em todos os pacientes, mas os métodos diretos são mais confiáveis do que o PHT.
Limitações e Problemas
As limitações e os problemas na avaliação da estenose mitral são os seguintes.
1. Nem todos os PHTs prolongados indicam estenose mitral. Pacientes com relaxamento anormal do miocárdio apresentam PHT prolongado, mas a velocidade de pico E não está aumentada (Fig. 7-18).
2. O PHT é afetado pela insuficiência aórtica concomitante ou por um estado de complacência diminuída. Uma elevação rápida na pressão diastólica do ventrículo esquerdo nessas condições pode encurtar o PHT e subestimar a gravidade da estenose mitral. A área da valva mitral deve ser estimada pela planimetria bidimensional, pela equação de continuidade e pelo método de PHT. Qualquer diferença significativa entre as várias determinações deve ser explicada.
3. Insuficiência mitral concomitante pode subestimar a gravidade da estenose mitral quando a equação de continuidade é utilizada para o cálculo da área da valva mitral.
4. Pacientes com baixo débito cardíaco ou bradicardia podem ter um gradiente médio mais baixo, mesmo em presença de estenose mitral grave.
5. 0 jato da estenose mitral pode ser bastante excêntrico, o que pode ser útil para guiar o feixe Doppler de onda contínua utilizando a imagem de fluxo a cores.
Hemodinâmica de Exercício
Em pacientes que tenham, principalmente, sintomas aos esforços e nos quais a hemodinâmica de repouso não indica claramente a presença de uma estenose mitral grave, é útil a realização de um estudo Doppler durante ou imediatamente após o exercício (isto é, uma bicicleta ou uma esteira). Apesar de a área da valva mitral poder mudar levemente com o exercício, o aumento no débito cardíaco e na freqüência cardíaca irá resultar em aumento significativo no gradiente, na pressão de átrio esquerdo e na pressão da artéria pulmonar (Fig. 7-19). Assim, uma piora significativa da hemodinâmica com exercício pode ser útil para explicar os sintomas dos pacientes em face de uma alteração hemodinâmica leve a moderada. O PHT mostrou-se capaz de diminuir com o exercício, sugerindo que ele seja influenciado por outros fatores além da área da valva mitral. Assim, na maioria dos pacientes com estenose mitral, a hemodinâmica de exercício ao Doppler é útil para explicar a sintomatologia quando o estudo em repouso mostra um grau menos acentuado de estenose mitral.
Implicações Clínicas
A ecocardiografia é atualmente o padrão ouro para avaliação da estenose mitral, diminuindo a necessidade de cateterismo cardíaco. Esta técnica não-invasiva é bem adequada para exames seriados na avaliação da progressão da doença.
Quando se considera a realização de valvuloplastia mitral por balão, a ecocardiografia transesofágica énecessária para excluir a presença de trombo no interior do átrio esquerdo.
Avaliação da Insuficiência Valvar
A ecocardiografia em modo-M e bidimensional é útil na avaliação da insuficiência valvar pela demonstração de um substrato anatômico para a regurgitação (por exemplo, prolapso da valva mitral, endocardite, valva aórtica bicúspide, dilatação do anel, carcinóide etc.), medindo o tamanho do ventrículo esquerdo e a função sistólica global, e ocasionalmente revelando o impacto hemodinâmico da regurgitação (Fig. 7-20). Entretanto, a gravidade da regurgitação valvar não pode ser avaliada seguramente apenas pela ecocardiografia bidimensional.
A modalidade ecocardiográfica semiquantitativa primária para avaliação da regurgitação valvar é a imagem de fluxo a cores, que mostra o fluxo sangüíneo intracavitário semelhante à angiografia qualitativa. O critério para determinação da gravidade da regurgitação na imagem de fluxo a cores é baseado na largura e na área do jato regurgitante. Entretanto, a avaliação da gravidade da regurgitação valvar deve ser baseada não somente na imagem de fluxo a cores, mas também nos dados hemodinâmicos obtidos por ecocardiografia Doppler de onda contínua e pulsada. Esta abordagem integrada para avaliação da função valvar é discutida em detalhes na seção seguinte. Métodos mais novos e mais quantitativos de determinação do volume regurgitante, da fração regurgitante e do orifício regurgitante, utilizando a área de superfície proximal de isovelocidade (PISA) e a fórmula básica do orifício hidráulico (isto é, fluxo = área x velocidade), são também descritos neste capítulo.
Insuficiência Aórtica
Ecocardiografia Bidimensional e Modo-M
A etiologia da insuficiência aórtica varia amplamente e inclui a valva congenitamente anormal, a dilatação da aorta ascendente, a síndrome de Marfan, a endocardite, a dissecção aórtica, a disfunção de prótese valvar e, mais comumente, a valva aórtica degenerativa calcificada. Estas anormalidades estruturais são facilmente detectadas pela ecocardiografia bidimensional transtorácica e transesofágica (TEE). A ecocardiografia modo-M é ocasionalmente útil para demonstrar o fechamento prematura da valva mitral ou a abertura diastólica da valva aórtica como um sinal de insuficiência aórtica grave, geralmente aguda, e de elevação acentuada da pressão diastólica do ventrículo esquerdo. Entretanto, o Doppler modo-M virtualmente substitui os estudos padrões de modo-M como método de avaliação da gravidade da insuficiência aórtica.
Imagem Doppler/ Fluxo a Cores
A avaliação ecocardiográfica da gravidade da insuficiência aórtica requer uma avaliação meticulosa da imagem de fluxo a cores, do jato de regurgitação aórtica com Doppler de onda contínua, e a análise com Doppler de onda pulsada da aorta torácica descendente e do fluxo mitral. A imagem de fluxo a cores da insuficiência aórtica é melhor obtida a partir das visões paraestemais de eixos longos e curtos (pela janela ecocardiográfica transtorácica) ou a partir da visão da via de saída do ventrículo esquerdo (pela janela de TEE).
Quando a imagem de fluxo a cores foi comparada com a angiografia aórtica, a maior extensão ou complemento do jato de insuficiência aórtica esteve pobremente relacionada à gravidade angiográfica da regurgitação dessa valva. A área do jato regurgitante obtida pela imagem de eixo curto paraesternal relativa à área de eixo curto da via de saída do ventrículo esquerdo, ao nível do anel aórtico, correlaciona-se melhor com a gravidade angiográfica da insuficiência aórtica [19]. A largura do jato de insuficiência aórtica na sua origem relativa ao tamanho da via de saída do ventrículo esquerdo também demonstrou ser um bom preditor da gravidade angiográfica da insuficiência aórtica (Fig. 7-21). Existem outros achados Doppler que devem ser utilizados para determinação da gravidade da insuficiência aórtica. Nesta lesão, os sinais do PHT da insuficiência aórtica, [20, 21] (Fig. 7-22), a presença de fluxo diastólico reverso na aorta descendente (Fig. 7-23) e o tempo de desaceleração (DT) da velocidade de fluxo mitral inicial (Fig. 7-24) devem ser medidos [22]. Com a piora do quadro de insuficiência aórtica, a pressão diastólica do ventrículo esquerdo se torna elevada, resultando em um PHT encurtado do sinal Doppler de insuficiência aórtica e DT mitral. O volume regurgitante e sua fração podem ser quantificados como descrito no Capítulo S. Se não existir insuficiência mitral significativa, o fluxo através da valva mitral (MV) pode ser utilizado para representar o volume de fluxo sistêmico:
Fluxo da MV = área do anel da MV x TVI da MV
onde a área do anel da valva mitral é determinada pelo diâmetro do ane12 X 0,785, e a TVI da MV, pela colocação de um volume de amostra ao nível do anel da valva mitral.
O volume regurgitante é a diferença entre o volume ejetado através da via de saída do ventrículo esquerdo e o fluxo através da valva mitral, e a fração regurgitante (RF) é obtida pela seguinte equação:

Com base em dados obtidos a partir de Doppler bidimensional e imagem de fluxo a cores, a gravidade da insuficiência aórtica é determinada como se segue.
A insuficiência aórtica grave é definida por
1. jato de insuficiência aórtica (largura) /diâmetro (índice) da via de saída do ventrículo esquerdo de 60% ou mais
2. Área do jato de insuficiência aórtica/índice da área de saída do ventrículo esquerdo de 60% ou mais
3. PHT da insuficiência aórtica menor do que 250 ms
4. Padrão de fluxo mitral restritivo (no quadro agudo)
5. Reversão de fluxo holodiastólico na aorta descendente
6. Sinal de Doppler de onda contínua denso
7. Fração regurgitante de 55% ou maior
8. Volume regurgitante de 60 ml ou maior
9. Dimensão diastólica do ventrículo esquerdo de 7,5 cm ou maior (insuficiência aórtica crônica)
A insuficiência aórtica leve é definida por
1. Largura do jato de insuficiência aórtica/índice do diâmetro na via de saída do ventrículo esquerdo menor do que 30%
2. Área do jato de insuficiência aórtica/diâmetro na via de saída do ventrículo esquerdo menor do que 30%
3. PHT da insuficiência aórtica maior do que 400 ms
4. Reversão diastólica de fluxo leve precoce na aorta descendente
5. Sinal de Doppler de onda contínua fraco
6. Frações regurgitantes menores do que 30%
7. Dimensão diastólica do ventrículo esquerdo (crônica) de 6,0 cm ou menor
Insuficiência Mitral
Ecocardiografia de Modo-M e Bidimensional
Como na insuficiência aórtica, a ecocardiografia de modo-M e bidimensional é útil na detecção da etiologia subjacente à insuficiência mitral, como, por exemplo, o prolapso da valva mitral (Fig. 7-25), o flail mitral com ou sem cordas tendíneas rotas, calcificação do anel mitral, disfunção ou ruptura de músculos papilares, doença valvar reumática, fenda da valva mitral, endocardite e perfuração. Étambém útil no seguimento do tamanho e da função da cavidade do ventrículo esquerdo, principais determinantes do momento adequado para intervenção cirúrgica na insuficiência mitral.
Imagem de Fluxo a Cores/Doppler
Na imagem de fluxo a cores da insuficiência mitral, a área do jato regurgitante relativa ao tamanho do átrio esquerdo é mais preditiva da gravidade da regurgitação determinada pela angiografia [23, 24] (Fig. 7-26). Entretanto, a imagem do fluxo a cores da insuficiência valvar é dependente da programação do ganho, da freqüência de repetição pulsada, da profundidade do campo, da direção do jato e das condições de obtenção dos dados. As paredes cardíacas adjacentes influenciam o tamanho do fluxo regurgitante a cores, caso o jato regurgitante seja excêntrico. O jato de fluxo dirigido contra a parede atrial parece ser menor do que um jato livre com mesmo volume regurgitante (efeito Coanda). Assim, o tamanho do jato na imagem de fluxo a cores deve ser interpretado no contexto da geometria do jato e dos limites sólidos das estruturas circunjacentes [25] (Fig. 7-27).
Na insuficiência mitral, a velocidade do fluxo anterógrado (influxo mitral) pode aumentar na insuficiência grave (especialmente com uma prótese com um orifício de área fixo), e o espectro Doppler de onda contínua pode ter uma configuração característica (devido a uma onda V) com uma intensidade aumentada. A velocidade Doppler da insuficiência mitral tende a ser menor (4-5 m/s), com gravidade aumentando devido a uma pressão de átrio esquerdo mais alta, reduzindo o gradiente sistólico transmitral (Fig. 7-28), a não ser que a pressão do ventrículo esquerdo esteja grandemente elevada (como na estenose aórtica ou na miocardiopatia hipertrófica obstrutiva). Na insuficiência mitral grave, pode ocorrer uma reversão sistólica de fluxo nas veias pulmonares [26,27] (Fig. 7-29).
O volume regurgitante e a fração regurgitante podem ser calculados para avaliação da gravidade da insuficiência mitral utilizando-se estudos bidimensionais /Doppler [28] (Fig. 7-30). Na ausência de insuficiência aórtica significativa, a diferença entre o fluxo da valva mitral e o fluxo na via de saída do ventrículo esquerdo é o volume mitral regurgitante. O fluxo através da valva mitral é calculado pelo produto da área do anel mitral e a TVI do fluxo, obtida pela colocação do volume de amostra no anel mitral. O fluxo na via de saída do ventrículo esquerdo é calculado pelo produto da área do anel aórtico e a TVI do fluxo, obtida pela colocação do volume de amostra no anel aórtico. A fração regurgitante é calculada pela divisão do volume regurgitante pelo fluxo através da valva mitral (MV) e multiplicando-se por 100.
RV MV = fluxo MV - fluxo LVOT
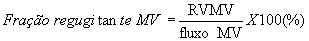
onde RV MV = volume regurgitante na MV.
Novas Abordagens Quantitativas
Vários pesquisadores tentaram quantificar o índice do volume do fluxo regurgitante utilizando o PISA pelo mapeamento do fluxo a cores e o princípio da continuidade do fluxo [29, 30]. Quando o fluxo (regurgitante) atravessa um orifício fixo, o fluxo converge como linhas de velocidade, aumentando próximo ao orifício. Uma série de linhas de isovelocidade pode ser desenhada tangencialmente às linhas radiais. A imagem de fluxo a cores Doppler pode identificar uma série de PISAs como uma interferência azul e vermelha, correspondendo às isovelocidades. O índice do volume de fluxo (ml/s) pode ser calculado como
2 pr² (cm²) x Vr (cm/s) = 6,28r² X Vr
onde 2pr² = Área de superfice hernisférica de isovelocidade proximal a uma distância radial r do orifício, e
Vr = velocidade de interferência à distância radial r.
Utilizando-se vários valores VÊ, a melhor correlação entre os índices de medida de fluxo e PISA foi encontrada quando o menor Vr e a maior dis tância radial correspondente (r) foram utilizados. O índice de volume de fluxo calculado não é afetado pelo formato do orifício ou por fatores ligados ao aparelho, tais como ganho, filtro, índice dos quadros. PISA pode ser obtido pelo modelo hemisférico ou hemi-elíptico. Embora o modelo hemi-elíptico pareça correlacionar-se melhor com a índice real de fluxo, e o modelo hemisférico subestime o índice, este segundo método é mais fácil de calcular. Este método pode tornar-se parte rotineira na estimativa do índice de fluxo do volume regurgitante, do volume regurgitante e do orifício regurgitante efetivo (ERO), mas são necessárias correlações clínicas.
O método progressivo de obtenção do índice de volume regurgitante, do tamanho do ERO e do volume regurgitante é o seguinte (Fig. 7-31).
1. Otimizar a imagem de fluxo a cores da insuficiência mitral a partir de uma janela apical (Fig. 7-31A).
2. Expandir a imagem da regurgitação na valva mitral (Fig. 7-31B); utilizar o zoom ou modo de seleção da expansão regional (RES).
3. Desvio no fluxo a cores basal para abaixo de 15 a 30 cm/s com velocidade negativa de interferência (Vr) (Fig. 7-31C).
4. Medir o raio (r) do hemisfério de isovelocidade proximal (Fig. 7-31C).
5. Obter uma velocidade de pico (V) e TVI do jato da insuficiência mitral (em cm/s e em cm, respectivamente) pela onda Doppler contínua.
6. Calcular o índice de fluxo da insuficiência mitral, o volume e o tamanho do orifício.
índice de fluxo (ml/s) = 2 pr² X Vr
= 6,28 X r² X Vr
ERO (cm²) = índice de fluxo/V (cm/s)
Volume regurgitante (ml) = ERO x TVI (ml)
Outro método quantitativo para medição da fração de insuficiência mitral, utilizando-se a velocidade média de amplitude-peso a partir do espectro Doppler de onda contínua, apresenta promessas. Embora esta nova técnica apresente limitações potenciais no paciente com um anel valvar muito aumentado (comparado com a largura do feixe de onda contínua), ela independe da necessidade de medir-se a área do ventrículo esquerdo em sua via de entrada e na sua via de saída [31].
Após a obtenção dos dados acima, os seguintes critérios sugerem uma insuficiência mitral grave:
1. Área do fluxo a cores maior do que 8,0 Cm² ou mais do que um terço da área do átrio esquerdo
2. Volume regurgitante de 60 ml ou mais
3. Fração regurgitante de 55% ou mais
4. ERO maior do que 0,35 Cm²
5. Reversão de fluxo sistólico na veia pulmonar
6. Sinal Doppler de onda contínua denso
7. Diminuição na configuração do Doppler de onda contínua
8. Aumento da velocidade E (> 1,5 m/s)
9. Dimensão diastólica do ventrículo esquerdo de 7,0 cm ou maior (crônica)
10. Tamanho do átrio esquerdo de 5,5 cm ou maior
Insuficiência Tricúspide
Ecocardiografia BidimensionalIModo-M
A ecocardiografia bidimensional /modo-M detecta a etiologia subjacente da insuficiência tricúspide, tal como febre reumática, prolapso, carcinóide (Fig. 7-32), doença de Ebstein, dilatação do anel, infarto do ventrículo direito e ruptura da valva tricúspide.
Imagem de Fluxo a Cores/Doppier
As características do Doppler anteriormente mencionadas a respeito da insuficiência mitral devem ser checadas sistematicamente e aplicadas na insuficiência tricúspide. Entretanto, em vez do fluxo reverso em veias pulmonares, a insuficiência tricúspide grave resulta em reversão do fluxo sistólico na veia hepática (Fig. 7-33). O sinal Doppler de onda contínua tricúspide é característico quando a regurgitação é grave: velocidade de fluxo aumentada para adiante, velocidade de regurgitação tricúspide relativamente diminuída e configuração sistólica tardia côncava da insuficiência tricúspide devido a uma grande onda "V" atrial (ver Fig. 7-33).
A insuficiência tricúspide grave é diagnosticada quando os seguintes critérios estão presentes:
1. Área de jato regurgitante no fluxo a cores de 30% ou mais da área do átrio direito
2. Sinal Doppler de onda contínua denso
3. Dilatação do anel (> 4 cm) ou coaptação inadequada das cúspides
4. Configuração sistólica tardia côncava do sinal de onda contínua
5. Velocidade de fluxo tricúspide anterógrado aumentada (> 1,0 m/s)
6. Reversão de fluxo sistólico na veia hepática
Insuficiência Valvar em Pacientes Normais
Deve ser observado que graus variáveis de insuficiência valvar, de mínimos a leves, são comuns na população normal e sua prevalência aumenta com a idade [32, 33] (Quadro 7-2). A técnica de imagem Doppler de fluxo a cores é tão sensível que chega a detectar graus mínimos a leves de insuficiência valvar, freqüentemente não encontrados até mesmo à ausculta cardíaca cuidadosa. Klein e colegas [33] verificaram a prevalência de insuficiência valvar relacionada com a idade em 118 pacientes voluntários normais por imagens nítidas de fluxo a cores. A insuficiência das valvas mitral, aórtica, tricúspide e pulmonar foi detectada em 48, 11, 65 e 31% das pessoas estudadas, respectivamente (ver Quadro 7-2). A insuficiência aórtica esteva ausente nos voluntários que tinham menos de 50 anos de idade. Não houve influência do sexo na freqüência da insuficiência valvar. Apesar de não ser hemodinamicamente importante, a detecção por Doppler da insuficiência valvar é útil na estimativa das pressões intracardíacas direitas. Quando émínima a regurgitação detectável por Doppler, não há necessidade de profilaxia para endocardite bacteriana subaguda.
Ecocardiografia Transesofágica
O diagnóstico da estenose valvar geralmente não requer auxílio da abordagem transesofágica, uma vez que o Doppler de onda contínua é a maneira primária de avaliar a gravidade das lesões estenóticas. Mesmo com a imagem bidimensional da estrutura valvar sendo subótima, o exame Doppler de onda contínua pode ser bastante satisfatório para avaliar a gravidade hemodinâmica da valva estenosada. Recentemente, o Doppler de onda contínua tem sido incorporado àecocardiografia transesofágica (TEE) e irá auxiliar na avaliação hemodinâmicas das valvas estenóticas, especialmente da mitral e da pulmonar, uma vez que seu jato de fluxo é geralmente paralelo à direção do feixe ultra-sônico transesofágico (Fig. 7-34). Esta modalidade é especialmente útil durante o procedimento intra-operatório (isto é, na determinação do gradiente transvalvar mitral após o reparo da valva mitral e anuloplastia) ou no procedimento intervencionalista (isto é, na valvuloplastia mitral por balão para estenose mitral). A planimetria para determinação da área da valva aórtica estenótica pode ser conseguida através da imagem bidimensional transesofágica.
A abordagem tomográfica biplano ou multiplano irá fazer a visão de eixo curto da valva aórtica mais facilmente disponível para esta finalidade. A TEE éessencial para avaliação da insuficiência valvar em certos pacientes. Em alguns destes, a calcificação anular densa freqüentemente previne a visualização adequada do jato de fluxo a cores na cavidade atrial, a partir das janelas precordiais. Entretanto, as características do jato regurgitante dependem da velocidade do jato e de fatores instrumentais. A imagem. de fluxo a cores do jato regurgitante pela TEE produz características do jato diferentes daquelas obtidas pela ecocardiografia transtorácica. Quando os mesmos pacientes com insuficiência mitral foram estudados tanto por ecocardiografia transtorácica como pela transesofágica, a abordagem transtorácica geralmente mostrou jatos regurgitantes com um padrão mosaico menor (47% da área regurgitante total), enquanto a área de mosaico detectada pela TEE constituiu 70% do jato regurgitante [34]. A melhor correlação com a gravidade angiográfica da insuficiência mitral foi obtida pela área de regurgitação transtorácica total e pela área de mosaico transesofágica. Com a TEE monoplano, uma área de mosaico inferior a 3 cm² indicava uma insuficiência mitral leve (96% de sensibilidade e 100% de especificidade) e uma área de mosaico maior do que 6 cm² indicava uma regurgitação grave [35] (91% de sensibilidade e 100% de especificidade). A abordagem transesofágica é melhor do que a abordagem transtorácica na avaliação do fluxo reverso sistólico em veias pulmonares, que sugere insuficiência mitral grave (ver Fig. 7-29). A abordagem transesofágica é também ideal na avaliação da morfologia das valvas mitral e tricúspide [36]. Assim, quando a etiologia ou o grau de regurgitação valvar se encontra em dúvida, a TEE passa a ser o passo seguinte natural (Figs. 7-35 e 7-36). Em todos os pacientes que são considerados para valvuloplastia mitral com balão, a TEE deve ser realizada para excluir a presença de trombo no átrio esquerdo ou no apêndice auricular esquerdo [36, 37]. A Figura 7-37 mostra um grande átrio esquerdo e um trombo no apêndice atrial esquerdo visualizado por TEE, mas não visualizado no exame transtorácico.
A ecocardiografia transesofágica tem um importante papel no intra-operátorio, para a reconstituição valvar [38-411. Isto é discutido com mais detalhes no Capítulo 17.
Impacto Clínico
Quando o paciente é submetido a uma avaliação ecocardiográfica para doença cardíaca valvar, os parâmetros listados abaixo devem ser avaliados utífizando-se a abordagem integrada bidimensional, Doppler contínuo e pulsado e imagem de fluxo a cores. Em alguns pacientes, pode ser necessária a ecocardiografia transesofágica.
1. Dimensão e função sistólica do ventrículo esquerdo
2. Espessura e massa da parede do ventrículo esquerdo
3. Morfologia valvar
4. Hemodinâmica valvar
a. Volume ejetado e débito cardíaco
b. Gradientes de pressão
c. Área valvar
5. Regurgitação valvar
a. Abordagem semiquantitativa (fluxo a cores): leve = grau I; moderado = grau II; moderadamente grave = grau III; grave = IV
b. Abordagem quantitativa: volume regurgitante; fração regurgitante; área de orifício efetiva
6. Pressão da artéria pulmonar
Deve ser enfatizado que a determinação da gravidade da lesão valvar é baseada em todos os dados ecocardiográficos disponíveis (abordagem integrada). Qualquer discrepância entre os diferentes parâmetros da gravidade deve ser explicada. Por exemplo: um paciente tem um gradiente de pressão aórtico médio de 55 mmHg, mas a valva aórtica não parece estar gravemente estenótica na imagem bidimensional. Uma avaliação mais cuidadosa mostra que o débito cardíaco está aumentado devido a anemia significativa, refletindo um aumento da velocidade de fluxo na via de saída do ventrículo esquerdo e TVI. Utilizando-se uma abordagem ecocardiográfica integrada, a avaliação da doença valvar cardíaca deve ser completa na maioria dos pacientes. Quando há necessidade de intervenção cirúrgica, os pacientes com doença coronária suspeitada ou em alto risco irão requerer angiografia coronária. Avaliação hemodinâmica pelo cateterismo cardíaco é necessária somente naqueles pacientes nos quais exames adequados bidimensionais Doppler e de imagem de fluxo a cores não possam ser realizados (aproximadamente 5%), ou naqueles pacientes nos quais existam discrepâncias acentuadas entre os achados clínicos e bidimensionais /Doppler (clinicamente grave versus leve ao Doppler), e que não sejam corrigíveis por exames repetidos por um membro mais experiente do grupo de ecocardiografia.
Referências
1. Callahan MJ, et al. Validation of instantaneous pressure gradients measured by continuous wave Doppler in experimentally induced aortic stenosis. Am 1 Cardiol 1985:56.989-993.
2. Smith MD, et al. Correlation of continuous wave Doppler velocities with cardiac catheterization gradients: an experimental model of aortic stenosis. 1 Am Coll Cardiol 1985; 6-1306-1314.
3. Currie PJ, et al. Continuous-wave Doppler echocardiographic assessment of severity of calcified aortic stenosis: simultaneous Doppler catheter correlative study in 100 adult patients. Circulation 1985;71:11621169.
4. Gorlin, R, Gorlin SG. Hydraulic formula for calculation of the area of the stenotic mitral valve, other cardiac valves, and central circulatory shunts. Am Heart 11951;41:1-45.
5. Skjaerpe (> Hegrenaes L, Hatle L. Noninvasive estimation of valve area in patients with aortic stenosis by Doppler ultrasound and two-dimensional echocardiography. Circulation 1985;72:810-818.
6. Zoghbi WA, et al. Accurate noninvasive quantification of stenotic aortic valve area by Doppler echocardiography. Circulation 1986; 73:452-459.
7. Otto CM, et al. Determination of the stenotic aortic valve area. in adults using Doppler echocardiography. I Am Coll Cardiol 1986; 7:509-517.
8. Teirstein P, et al. Doppler echocardiographic measurement of aortic valve area in aortic stenosis: a noninvasive application of the Gorlin formula. I Am Coll Cardiol 1986;8:1059-1065.
9. Oh JK, et al. Prediction of the severity of aortic stenosis by Doppler aortic valve area determination: prospective Doppler-catheterization correlation in 100 patients. I Am Coll Cardiol 1988; 11:1227-1234,
10. Hatle L, et al. Noninvasive assessment of pressure drop in mitral stenosis by Doppler ultrasound. Br Heart J 1978;40:131-140.
11. Nakatani S, et al. Value and limitations of Doppler echocardiography in the quantification of stenotic mitral valve area: comparison of the pressure half-time and the continuity equation methods. Circulation 1988;77:78-85.
12. Nakatani S, et al. Time related changes in mitral valve area after balloon mitral valvuloplasty assessed by Doppler continuity equation method. Circulation 1988 (Suppl 11);78:487-495.
13. Thomas JD, et al. Inaccuracy of mitral pressure half-time immediately after percutaneous mitral valvulotomy. Circulation 1988;78:980-993.
14. Chen. C, et al. Reliability of the Doppler pressure half-time method for assessing effects of percutaneous mitral balloon valvuloplasty. J Am Coll Cardiol 1989; 13:1309-1313.
15. Hegrenaes L, Hatle L. Aortic stenosis in adults: noninvasive estimation of pressure differences, by continuous wave Doppler echocardiography. Br Heart J 1985;54:396-404.
16. Abascal V, et al. Echocardiographic evaluation of mitral valve structure and function in patients followed for at least 6 months after percutaneous balloon mitral valvuloplasty. J Am Coll Cardiol 1988; 12:606-615.
17. Holen J, et al. Determination of pressure gradient in mitral stenosis with a noninvasive ultrasound Doppler technique. Acta Med Scand 1976; 199:455-460.
18. Come P, et al. Noninvasive assessment of mitral stenosis before and after percutaneous balloon mitral valvuloplasty. Am J Cardiol 1988;61:817-825.
19. Perry GJ, et al. Evaluation of aortic insufficiency by Doppler color flow mapping. Am Coll Cardiol 1987; 9:952-959.
20. Teague SM, et al. Quantification of aortic regurgitation utilizing continuous wave Doppler ultrasound. J Am Coll Cardiol 1986;8:592-599.
21. Samstad SO, et al. Half time of the diastolic aortoventricular pressure difference by continuous wave Doppler ultrasound: a measure of the severity of aortic regurgitation? Br Heart J 1989;61:336-343,
22. Oh JK, et al. Characteristic Doppler echocardiographic partern of mitral inflow velocity in severe aortic regurgitation. J Am Coll Cardiol 1989;14:17121717.
23. Helmcke F, et al. Color Doppler assessment of mitral regurgitation with orthogonal planes. Circulation 1987;73:175-183.
24 Spain MG, et al. Quantitative assessment of mitral regurgitation by Doppler color flow imaging: angiographic and hemodynamic correlations. J Am Coll Cardiol 1989; 13:58 5-590.
25. Cape EG, et al. Adjacent solid boundaries alter the size of regurgitant jets on Doppler color flow maps. J Am Coll Cardiol 1991; 17:1094-1102,
26. Klein AL, Tajik AJ. Doppler assessment of pulmonary venous flow in healthy subjects and in patients with heart disease. J Am Soe Echocardiogr 1991;4:379-392.
27. Castello R, et al. Effect of mitral regurgitation on pulmonary venous velocities derived from transesophageal echocardiography colorguided pulsed Doppler imaging. J Am Coll Cardiol 1991;17:14991506.
28. Kaneshige AM, Enriquez-Sarano ME. Mitral regurgitation: Echocardiographic assessment of its severity and the optimal timing of operation. Cardio 1993;4148.
29. Utsunomiya (> et al. Doppler color flow "proximal isovelocity surface area" method for estimating volume flow rate: effects of orifice shape and machine factors. J Am Coll Cardiol 1991; 17: 1103-1111.
30. Recusani F, et al. A new method for quantification of regurgitant flow rate using color Doppler flow imaging of the flow convergence region proximal to a discrete orifice. Circulation 1991;83:594-604.
31. Jenni R, et al. Quantification of mitral regurgitation with amplitude-weighted mean velocity from continuous wave Doppler spectra. Circulation 1989; 79:1294-1299.
32. Yoshida K, et al. Color Doppler evaluation of valvular regurgitation in normal subjects. Circulation 1988;78:840-847.
33. Klein AL, et al. Age-related prevalence of valvular regurgitation in normal subjects: a comprehensive color flow examination of 118 volunteers. J Am Soc Echocardiogr 1990; 2:54-63.
34. Castello R, et al. Variability in the quantitation of mitral regurgitation by Doppler color flow mapping: comparison of transthoracic and transesophageal studies. J Am Coll Cardiol 1992;20:433438.
35. Castello R, et al. Quantitation of mitral regurgitation by transesophageal echocardiography with Doppler color flow mapping. correlation with cardiac catheterization. J Am Coll Cardiol 1992; 19:1516-1521.
36. Sochowski RA, et al. Comparison of accuracy of transesophageal versus transthoracic echocardiography for the detection of mitral valve prolapse with ruptured chordae tendineae (flail. mitral leaflet). Am J Cardiol 1991; 67:1251-1255.
37. Jaarsma W, et al. Transesophageal echocardiography during percutaneous balloon mitral valvuloplasty. Am Soc Echocardiogr 1990; 3:384-391.
38. Kleinman JP, et al. A quantitative comparison of transesophageal and epicardial color Doppler echocardiography in the intrapperative assessment of mitral regurgitation. Am J Cardiol 1989;64:1168-1172.
39. Sheikh KH, et al. The utility of transesophageal echocardiography and Doppler color flow imaging in patients undergoing cardiac valve surgery. J Am Coll Cardiol 1990; 15:363-372.
40. Stewart WJ, Salcedo EE, Cosgrove DM. The value of echocardiography in mitral valve repair. Cleve Clin J Med 1991;58:177-183.
41. Freeman WK, et al. Intraoperative evaluation of mitral valve regurgitation and repair by transesophageal echocardiography: incidence and significance of systolic anterior motion. J Am Coll Cardiol 1992;20:599-609.
Copyright © 2000 eHealth Latin America