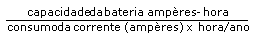Capítulo 09 - Marcapasso Cardíaco
Capítulo 09 - Marcapasso Cardíaco
J. Warren Harthorne
Andrew C. Eishauer
David M Steinhaus
Aspectos Históricos do Marcapasso Cardíaco
Quando o coração está doente, seu trabalho se realiza de forma imperfeita: os vasos que partem do coração tornam-se inativos, de forma que você não pode senti-los... Se o coração estremece, tem pouca força e definha, a doença está avançando. Imhotep, ca. 3.500 a.C. 35
Muitas vezes o homem tem sido abandonado pela habilidade e cuidado dos médicos, porém a esperança só desaparece quando seus pulsos enfraquecem. Ovídeo108
A primazia do coração na sustentação final dos seres vivos tem sido um tema debatido intensamente há vários séculos. O reconhecimento de sua importância data de períodos pré-históricos dos homens das cavernas de 5.000 anos a.C., como se evidencia pelos escritores nas cavernas de Altamira, Espanha (Fig. 9-1). De acordo com o dogma do pulso galênico, todo órgão tinha seu próprio pulso e qualquer doença, seu próprio desequilíbrio nesta função; esse conceito continuou sendo popular por muitos séculos a partir de então.137 Aproximadamente 300 a.C., Herófilo assinalou que "quando a morte repentina acontece sem qualquer causa evidente, então ela se deve à paralisia do coração".137 descrição subjetiva das alterações na regularidade ou potência do pulso levou a contribuições gráficas e poéticas ("Meu pulso, como o seu, marca sobriamente o tempo e compõe uma música saudável" Shakespeare, em Hamlet), porém a quantificação do pulso precisou do desenvolvimento do relógio. Os chineses relacionavam o pulso do paciente à freqüência respiratória do médico. Vários relógios d'água foram usados durante a Idade Média. Galileo Galilei (1564-1642) introduziu o princípio do metrônomo, após observar o movimento pendular de um candelabro na catedral de Pisa e, depois disso, foram efetuadas várias modificações. Em 1707, John Floyer publicou um tratado sobre o relógio de pulso do médico, que introduziu pela primeira vez o ponteiro de 1 minuto.47 Suas observações não conseguiram reconhecimento amplo, de forma que a quantificação do pulso continuou sendo uma técnica inexata, durante a maior parte do século 18.
Em 1789, Marcus Gerbezius apresentou um registro extremamente convincente dos abalos de Stokes-Adams, assim como Cheyne em 1733, Von Haller em 1754 e Morgagni em 1761.94,99 O relato de Morgagni apresenta a primeira descrição completa:99
Eu examinarei apenas superficialmente, em tão poucas palavras quantas me forem possíveis, as muitas coisas que tenho observado por muito tempo em meu concidadão Anastasio Poggi, um padre circunspecto e confiável. Ele tinha 68 anos e constituição moderadamente obesa e florida quando, pela primeira vez, foi acometido de epilepsia, que lhe deixava depois uma lentificação das mais intensas no pulso e, de certa forma, um resfriamento do corpo... Na maioria das vezes, as crises eram muito curtas, porém certamente graves, em virtude das distorções dos olhos, agitações dos membros e suspensão de todos os sentidos que sempre acompanhavam os ataques; frequentemente, havia um estrangulamento que, algumas vezes, acompanhava-se de um estertor; e depois, de vez em quando, da emissão involuntária de urina.
É preciso fazer um tributo à inteligência perquiridora de um jovem de 24 anos, Thomas Spens, que em 1792 apresentou uma excelente descrição do caso de um paciente com 54 anos, que sofreu vários episódios de síncope durante o intervalo de quatro dias, com pulso registrado de 9 a 24 bpm.142 O relato detalhado de outro caso e os achados subseqüentes da biópsia efetuados por Robert Adams em 1827 facilitaram a compreensão dessa entidade patológica, partindo de hipóteses descritivas e especulativas para a comprovação científica. Ele observou: "Nesses casos ... a apoplexia precisa ser considerada menos uma doença intrínseca do que um sintoma, cuja origem orgânica está no coração." Discussões sobre se as manifestações neurológicas precediam ou acompanhavam a lentificação do pulso foram realizadas por muitos autores, incluindo-se Brigth, Mayo, Gibson, Law, Chomal, Holberton, Addison, Speers, Worthington e Peacock e até incluíram um relato da literatura veterinária sobre o bloqueio cardíaco eqüino com síncope.119,137 Os estudos de autópsia revelavam, freqüentemente, hipertrofia do coração, sinais de aterosclerose e, em alguns casos, evidências de "ossificação" intracardíaca. O tratamento dos pacientes com essa doença incluía "algumas sanguessugas aplicadas atrás dos ouvidos; vesicatórios sobre a nuca; banhos de pés com mostarda".137
A publicação final de uma dissertação sobre o assunto por William Stokes em 1846 destilou e cristalizou os trabalhos precedentes, inclusive o de Adams, em uma discussão lúcida e abrangente, que foi muito pouco aperfeiçoada nos anos subseqüentes. 147 Seus dois casos relatados são longos, elaborados e eloqüentes e poderiam, perfeitamente, servir de modelo para seus colegas médicos da atualidade:147
Durante o mês corrente (junho), esse paciente foi novamente internado no hospital. Os fenômenos cardíacos continuavam como antes, porém surgira um novo sintoma, isto é, uma pulsação considerável na veia jugular direita. Ela é mais evidente quando o paciente está deitado. O número de pulsações reflexas é difícil de ser estabelecido, porém elas são mais do que o dobro do número de contrações ventriculares evidentes. A terceira pulsação é muito forte e súbita e pode ser observada à distância; as outras ondas são muito menos nítidas e algumas muito pequenas também podem ser percebidas. Essas podem corresponder, possivelmente, às contrações imperfeitas que já tinham sido observadas no coração. O aspecto do pescoço desse paciente é muito singular e a pulsação das veias é de um tipo que nós nunca tínhamos observado antes.
Nenhum epônimo poderia refletir com clareza e precisão as várias contribuições acumuladas durante vários séculos e de todos os hemisférios, descrevendo a síndrome das crises apopléticas que se acompanhavam de pulso lento. Uma publicação de Henry Huchard em 1890 e seu tratado posterior levaram à designação de síndrome de Stokes-Adams .75,76 A imparcialidade lógica e histórica estimula a preferência pelo termo síndrome de Morgagni-Adams-Stokes.
A descrição da anatomia microscópica do coração, no que se refere aos distúrbios do sistema de condução e à síncope cardíaca, é relativamente recente, porém os estudos de anatomia macroscópica datam de várias centenas de anos. Aristóteles efetuou estudos cuidadosos com embriões de galinha em torno de 350 a.C. e notou que "o pulso é inerente a qualquer constituição do coração e surge desde o início" 4,88 Galeno observou que "a faculdade pulsátil do coração tem sua origem em sua própria substância". 55 Estudos subseqüentes concentraram-se na função do coração e sua provável inter-relação com o sistema nervoso, ao invés do substrato anatômico do sistema de condução. A seqüência da contração atrioventricular (AV) foi observada por Galeno, através do estudo de ferimentos torácicos abertos em gladiadores moribundos e da dissecção animal; mais tarde, Harvey observou estes mesmos eventos. 70,135 As influências extrínsecas da irritação vagal mecânica sobre o coração foram assinaladas por Galeno, Vesalius e Da Vinci, porém somente no século 19 Eduard e Ernst Weber demonstraram os efeitos da estimulação galvânica sobre o nervo vago em coração de rã. 165
A existência do sistema de condução independente do miocárdio foi descrita em 1839 por Bogislaus Policki, cuja tese fundamentou-se no trabalho prévio, com ovelhas, de seu professor Johannes Purkinje.119 Células ganglionares na área do seio venoso do coração de rã foram descritas por Remak em 1844 e na junção AV por Friedrich Bidder em 1848.10,121 Investigações importantes sobre a propagação dos impulsos contráteis foram efetuadas por Stannius (1852) e Gaskell, Wooldridge, Tigerstedt e outros (1883-1884). 56,57,143,156,169 Suas pesquisas estabeleceram, conclusivamente, as vias da condução e introduziram os conceitos de bloqueio parcial, bloqueio completo e parada cardíaca. 137 A continuidade física das células ganglionares, que tinham sido identificadas antes nos átrios, com os feixes subendoteliais descritos por Purkinje, foi sugerida por John MacWilliam, porém só foi confirmada em 1893 por Wilhelrn His (Fig. 9-2); este autor aventou que essa poderia ser a origem, quando alterada, da síndrome de AdamsStokes .74.92 Outras contribuições marcantes para a compreensão da anatomia do nodo AV foram oferecidas por Aschoff e Tawara e, quanto ao nodo sinoatrial, por Wenckebach, Keith e Flack. 137
A invenção do galvanômetro filamentar por Willem Einthoven revolucionou o conhecimento acerca da ativação elétrica do coração. 14 O primeiro registro elétrico conhecido do bloqueio cardíaco foi publicado em 1906 (Fig. 9-3). A descrição precisa da seqüência fisiológica da síndrome de Adams-Stokes em pacientes com graus variáveis de bloqueio cardíaco passou a ser amplamente reconhecida. A produção experimental do bloqueio AV, com simulação da síndrome de Adams-Stokes em animais logo foi efetuada por muitos pesquisadores; Erlanger, porém, realizou estudos particularmente sofisticados, que lhe conferiram o Prêmio Nobel em 1944.39
Existem precedentes consideráveis para o conceito dos sistemas de marcapassos cardíacos. Há várias centenas de anos, havia interesse acerca da capacidade de substâncias como o âmbar ou a magnetita (pedraímã), de atraírem objetos.131,132 Da mesma forma, o reconhecimento de que certos peixes, principalmente o torpedo, possuíam a capacidade de produzir uma carga elétrica poderosa, suficiente para atordoar uma pessoa desatenta ou reanimar um monte de peixes mortos levou a um culto do tratamento, que começou na era romana.60 O tratamento da cefaléia, gota e prolapso anal, através da aplicação direta de um peixetorpedo vivo sobre a parte afetada pode causar repulsa ao leitor atual, porém a piscina de eletroterapia foi utilizada até muito recentemente, em 1860. 83,131
Afora algumas referências bíblicas de torturas, os primeiros geradores de eletricidade somente apareceram nos séculos 16 e 17. 131 Em 1729, Stephen Gray efetuou estudos importantes sobre a transmissão da corrente elétrica e análise de condutores e isolantes. Musschenbroek de Leyden inventou o capacitor, um aparelho mais tarde denominado garrafa de Leyden, em 1746.101 Nas sessões presenciadas por Luís XV, Nollet passou uma corrente elétrica através de fileiras de 180 soldados, ou 800 monges Cartuxos. 106.131 O conceito de positividade e negatividade dos campos elétricos foi introduzido por Benjamin Franklin. Em 1799, Volta desenvolveu na célula elétrica composta de metais diferentes que substituiu a garrafa de Leyden.160 No entanto, a utilização desta última para produzir contração muscular constituiu o fundamento para o campo da eletrofisiologia. Galvani concluiu que o "espírito animal" que controlava o organismo dos mamíferos, de acordo com os escritores mais antigos, na verdade era devido às correntes elétricas conduzidas.141 Foram desenvolvidos-vários métodos de eletroterapia para inúmeros distúrbios, principalmente na França durante os séculos 18 e 19 e de acordo com Schechter, "não há qualquer frivolidade na afirmação de que a eletricidade era exaltada, simplesmente por qualquer víscera ou orifício do corpo em oscilação".132 Entre os defensores e praticantes entusiastas estava John Wesley, fundador do Metodismo. Embora grande parte de seus esforços terapêuticos possa ser considerada charlatanismo pelos médicos da atualidade (e pelo Food and Drug Administration), uma análise cuidadosa sugere que algumas das técnicas da eletrificação corpórea total (eletroidríase ou eletrobalneoterapia) pelo menos promovia um aumento do fluxo sangüíneo para a pele80 e pode ter representado a primeira aplicação da redução da pós-carga, nos pacientes com disfunção ventricular esquerda crônica. Em 1872, Ducherme já assinalava que, "a dedução terapêutica é: a excitação eletrocutânea da região precordial que recobre o ápice do coração é um dos melhores métodos de se combater síncopes devidas à parada cardíaca e outros distúrbios funcionais da circulação cardíaca" 33 Vários pesquisadores estudaram a possibilidade de restaurar a ação cardíaca através da eletroestimulação e, em 1887, MacWilliam descreveu uma técnica de estimulação cardíaca externa. 8.93,163 Um dos primeiros relatos de ressuscitação bem-sucedida de um ser humano foi o de Robinovitch em 1909.124
A estimulação endocárdica do coração surgiu como conseqüência natural das experiências de Claude Bernard com cateterização cardíaca em animais. Várias inovações inteligentes foram introduzidas por Chauvreau (1899), Floresco (1905) e Marmorstein (1927), que confirmaram a eficácia e tecnologia da estimulação endocavitária no laboratório de fisiologia .23,46,96 Contudo, o equipamento usado era volumoso e inadequado para uso clínico.
O primeiro desenvolvimento definitivo direcionado para a recuperação de pacientes em assistolia cardíaca foi proporcionado pelo Dr. Albert S. Hyman em 1930. 78,79
O aparelho era grosseiro e desajeitado, segundo os critérios atuais: o giro de uma manivela ativava um mecanismo de molas, que fornecia seis minutos de estimulação através de uma agulha cardíaca introduzida diretamente no coração. As experiências clínicas envolveram 43 pacientes, dos quais 14 sobreviveram. O fracasso da técnica em obter aceitação foi atribuído à falta de documentação dos resultados na literatura médica, mais uma suspeita geral originada, sem dúvida, dos abusos generalizados com a eletroterapia durante o século precedente. 133 O interesse por um mecanismo diferente de ativação cardíaca, através da aceleração térmica do nódulo sinoatrial, levou Hellerstein e Liebow a criar um "termodo" para uso clínico.72.73 O Dr. William Sweet, do Massachusetts General Hospital, descreveu a estimulação manual direta do nódulo sinoatrial, para a assistolia durante cirurgias.151
O advento da cirurgia cardíaca trouxe um ímpeto renovado ao estabelecimento do controle efetivo do ritmo cardíaco. Os Drs. Bigelow, Callaghan e Hopps efetuaram investigações elaboradas em laboratório animal no Banting Institute em Toronto, durante o estudo da parada cardíaca hipotérmica.11 Seus trabalhos estimularam o interesse do Dr. Paul Zoll, cujo relato subseqüente em 1952, da estimulação transtorácica proposital do coração, com restauração eficaz da atividade cardíaca, foi um marco nesse campo, fundamentado nos estudos eletrofisiológicos cuidadosos de inúmeros cientistas há mais de 100 anos. 171
O Dr. J. Francis Dammann utilizou, pela primeira vez, a estimulação cardíaca pós-operatória através de eletrodos transtorácicos.136 Outros se seguiram com relatos de casos individuais, porém um grande avanço nesse campo foi proporcionado pelo Dr. C. Walton Lillehei e sua equipe.91 Embora a maior parte de seu trabalho implicasse na exposição direta do coração durante intervenções cirúrgicas cardíacas, eles também introduziram a técnica da inserção percutânea de um eletrodo transtorácico.154 A primazia dos cirurgiões cardíacos na assistência a esses pacientes talvez explique a ênfase curiosa na exposição direta do coração, ou punção direta através da parede torácica, a fim de iniciar a estimulação. A via venosa tinha sido usada em pequeno número de experiências, porém geralmente só conseguia chegar ao nódulo sinoatrial. Somente em 1958 o Dr. Seymour Furman introduziu a estimulação transvenosa temporária, no Montefiore Hospital em Nova Iorque.54 Durante o mesmo ano, a primeira introdução mundial de um marcapasso implantável foi efetuada em Estocolmo, Suécia, no sr. Arne Larsson, um engenheiro de 44 anos com bloqueio cardíaco pós-miocardite, pela equipe de cirurgiões liderada pelo Dr. Ake Senning.139 O receptor, apesar de duas dúzias ou mais de intervenções cirúrgicas, continua bem até hoje.
Progressos subseqüentes esclarecedores foram a introdução clínica do circuito de "demanda" não-competitivo, a estimulação em radiofreqüência e a estimulação ventricular sincrônica atrial. 20,59,105 Os sistemas de eletrodos, através dos quais o gerador de pulsos transmitia seu impulso ao miocárdio, foram aperfeiçoados, partindo das sondas de tachas de HunterRoth,77 até as sondas helicoidais de molas retráteis utilizadas atualmente.
A "juventude" relativa da especialidade da estimulação cardíaca é exemplificada pelo fato de que o primeiro receptor mundial de um aparelho implantável permanente e a maioria dos pioneiros nesse campo ainda estão vivos e, em muitos casos, atuando ativamente na prática médica ou engenharia. Uma exceção é o Dr. Hilbert J. Th. Thalen, conhecido mundialmente como "Bert" como era chamado por seus amigos.Ele iniciou uma carreira simultânea em medicina e engenharia na University of Groningen na Holanda, em 1960, passou um ano em pesquisas de pósgraduação na unidade cardíaca do Massachusetts General Hospital e morreu em outubro de 1982, com 43 anos. Seus interesses eram ecléticos e cobriam todo o espectro da tecnologia dos marcapassos, assim como medicina do esporte e cardiologia geral. Suas principais contribuições na estimulação cardíaca incluíram o desenvolvimento da técnica fotoanalítica para avaliar as ondas de pulso, a criação do marcapasso Groningen (mais tarde Vitatron), assim como várias inovações no desenho dos eletrodos, incluindo-se a conformação com ponta anular usada atualmente. Ele atuou como Secretário-Geral no 4º. Simpósio Internacional sobre Estimulação Cardíaca realizado em Groningen em 1973 e estabeleceu um padrão de excelência para esses encontros, muitas vezes efetuados durante os anos subseqüentes.
Eletrônica Básica dos Marcapassos
O marcapasso pode ser considerado como um sistema composto de 4 elementos: (1) fonte de energia; (2) circuito eletrônico; (3) envoltório do gerador de pulso, que protege a bateria e o circuito do contato com os líquidos do corpo, e (4) as sondas do marcapasso. Assim como a força de uma corrente é determinada por seu elo mais fraco, também a confiabilidade final de um marcapasso é definida pelo componente que falha primeiro.64
Fonte de Energia
A fonte de energia dos sistemas de marcapasso é constituída por vários tipos de baterias ou geradores de força. As baterias mais comumente utilizadas no passado foram as eletroquímicas, como a bateria de mercúrio-zinco (célula primária) e a bateria de níquel-cádmio substituível (célula secundária). Baterias de lítio são sólidas ou líquidas e, atualmente, são representadas por uma família extensa de células, dependendo do sal de lítio usado e das variações na encapsulação interna. Fontes de energia nuclear são geradores mais poderosos que as baterias e isso também vale para os sistemas de células biogalvânicas experimentais. São aconselháveis alguns comentários gerais acerca das fontes de energia, antes do estudo mais pormenorizado dos tipos específicos de células.
Normalmente, uma célula ou bateria consiste num eletrodo positivo único (catodo) e um eletrodo negativo (anodo), separados por um meio eletrolítico ionicamente condutor. A conexão a um circuito externo faz com que os elétrons circulem do anodo para o catodo, com depleção gradativa de seus elementos constituintes, em virtude da reação eletroquímica resultante. Teoricamente, a quantidade de material ativo contido no interior da célula ao iniciar sua vida (BOL) determina a quantidade de elétrons que a bateria pode fornecer até o término de sua vida útil (EOL). A quantidade total de carga presente é denominada capacidade coulômbica e é medida em ampére-horas. A densidade energética de uma célula refere-se à taxa de fornecimento energético teórico em relação ao volume (densidade energética por volume), ou massa celular (densidade energética gravimétrica). Uma densidade energética alta possui algumas vantagens clínicas evidentes, sob o ponto de vista da miniaturização dos geradores do marcapasso e preservação de sua longevidade. A quantidade de energia que uma célula pode teoricamente, proporcionar, é determinada através do produto de sua capacidade coulômbica pela voltagem do circuito aberto. A quantidade máxima nunca é efetivada, em virtude de várias perdas internas e autodescarregamento. Nas células de zinco-mercúrio usadas inicialmente, a autodescarga era um problema significativo, em virtude dos circuitos internos curtos criados pelos crescimentos dendríticos do mercúrio metálico. Outros desvios do rendimento esperado ocorrem após a implantação, de forma que o médico prudente deve ser criteriosamente cético em relação às estimativas exageradas do fabricante acerca da longevidade do marcapasso.
Células de Mercúrio-Zinco
As baterias de mércurio-zinco eram "células primárias" e consistiam de eletrodos de óxido de mercúrio e zinco dispersos em um eletrólito alcalino. Este último é cáustico e acarretava risco, quando havia extravasamento do interior da célula para a câmara de gás existente nessas baterias. A dissolução eletrolítica das porções adjacentes do circuito eletrônico causava, freqüentemente, o colapso imprevisível e catastrófico do marcapasso. Uma discussão detalhada sobre a química dessas células tem interesse apenas histórico, já que elas foram totalmente substituídas pelas baterias de lítio. No entanto, deve-se assinalar que esses dispositivos ofereciam uma meia-vida efetiva da fonte de energia para aproximadamente 40% dos receptores de marcapasso, cuja longevidade era limitada por outros fatores.63
Células Recarregáveis
O conceito de uma fonte de energia recarregável externamente para a utilização do marcapasso não tem origem recente, já que tal dispositivo foi usado na primeira implantação mundial de marcapasso "permanente", em 1958.138 Contudo, seu rendimento era variável. A célula de níquel-cádmio recarregável é uma célula "secundária" usada em vários aparelhos familiares domésticos e de jardinagem. A deterioração gradativa à temperatura corporal e a produção de gases durante o ciclo de carregamento impediam sua utilização inicial nos marcapassos cardíacos. Pesquisas intensivas efetuadas no Johns Hopkins Applied Research Laboratory foram iniciadas em 1967 e resultaram em modificações na célula de níquel-cádmio padronizada, que permitiram vedação hermética e retenção da carga em temperaturas corpóreas durante períodos prolongados. A implantação clínica dos marcapassos alimentados por essa célula começaram em 1973. * A utilização de células semelhantes nos satélites espaciais indicava um rendimento estável e confiável, apesar das centenas de ciclos de carregamento. A experiência clínica subseqüente com um marcapasso comercial alimentado por essa fonte de energia confirmou os resultados altamente confiáveis. A necessidade do paciente recarregar o sistema semanalmente (mais tarde, mensalmente) não parecia acarretar num impedimento físico ou psicológico significativo. Havia um entusiasmo considerável acerca desse método, quando as baterias de lítio surgiram. Tem sido descrita uma célula de óxidos de prata e mercúrio de vida longa, capaz de reter carga suficiente para a estimulação cardíaca por três a cinco anos, esta célula, porém, nunca foi extensamente usada na prática clínica. 157
Células de Lítio
O lítio mostrou-se extremamente conveniente na construção de baterias para marcapassos, já que tem densidade energética elevada e forma um cátion fortemente reativo com vários materiais de catodo, resultando em alta vontagem e custo relativamente reduzido.116 Das cinco baterias de lítio até hoje introduzidas para uso clínico, duas utilizam sistemas eletrolíticos sólidos e três empregam eletrólitos líquidos. O lítio tem o maior potencial eletroquímico de todos os elementos metálicos e um peso equivalente próximo ao mais leve, de forma que o resultado é a maior densidade energética. Interação violenta com a água impede sua utilização com eletrólitos baseados na água e, em geral, é necessária a vedação hermética da bateria para evitar seu contato com os líquidos teciduais. Isso é facilitado pela ausência de produção de gás ou outros subprodutos voláteis durante seu descarregamento; essa propriedade também pode proporcionar maior segurança e reduz a incidência de falha catastrófica. Em muitos sistemas de células de lítio existentes atualmente, há algumas diferenças na interação química e construção interna42,91,138,167. Para o médico, deve-se enfatizar diferenças de rendimento, incluindo-se variações na capacidade coulômbica proporcional das células específicas, o mecanismo provável de falha e a longevidade esperada do marcapasso. Veja o Quadro 9-1 para uma comparação relativa das fontes de energia usadas no passado. Em geral, as células de iodeto de lítio desenvolvem elevação progressiva na resistência interna, com diminuição praticamente linear resultante na voltagem da célula, refletida pelo declínio lento na taxa de estimulação. As células de cromato de lítio e prata (SAFT; não mais usadas nos marcapassos) e as de sulfeto de cobre e lítio (Dupont/Cordis) possuem, teoricamente, voltagem dupla e, portanto, platôs de freqüência; quando o platô de voltagem secundário (menor) é atingido, a freqüência diminui repentinamente até um nível mais baixo. Teoricamente, a vigilância mais cuidadosa no início do nível secundário poderia possibilitar a substituição do gerador, antes de sua falência total. Dentre as células de lítio existentes até então, as de cloreto de tionil e lítio GTE/ARCO e as de sulfeto de chumbo e lítio de Mallory foram substituídas, em virtude das características indesejáveis de sua interrupção de funcionamento.
Fontes de Energia Nucleares
Uma discussão sobre fontes de energia nuclear tem significado principalmente histórico, e não importância clínica prática, já que a disponibilidade das fontes de lítio confiáveis, o temor dos riscos de irradiação do receptor ou do ambiente ainda não comprovados e o elevado custo inicial têm limitado a utilização das fontes de energia nuclear a uma população extremamente selecionada. Esta fonte de energia é um gerador de energia, não uma bateria. O plutônio-238 na forma de óxido tem meia-vida de 86,4 anos e é contido no interior de uma cápsula de cerâmica. Os primeiros sistemas utilizavam um isolante térmico em torno dessa cápsula; os sistemas subseqüentes empregavam o telureto de bismuto como material de conversão. Esse sistema termoelétrico, ou pilha térmica, utiliza o calor produzido pela deterioração radioativa do isótopo para produzir potencial elétrico pelo efeito de Seebeck. A concentração de calor máximo no binário térmico é facilitada pelos isolantes térmicos. A voltagem resultante liberada pode ser insuficiente e precisar ser aumentada por um conversor DC-DC, possível fonte de falência eletrônica. A irradiação ambiental ou dos tecidos locais é minimizada pelo encapsulamento metálico e pelo comprimento de onda relativamente curto da emissão alfa. Têm sido expressas preocupações acerca dos níveis de radiação aumentados com o tempo, à medida em que o plutônio-238 se transforma em plutônio-236,44 a intensidade desse problema potencial, porém, ainda não foi estabelecida.
Fontes de Energia Biogalvânicas
O conceito de marcapasso alimentado por energia biológica tem interessado engenheiros há muitos anos. Sistemas que usam a deformação de cerâmica piezoelétrica ligada a várias partes do sistema respiratório ou cardiovascular têm sido desenvolvidos como fonte de energia para estimular o coração. 26,27.38,126 Até o momento, nenhum deles obteve importância clínica prática. A oxidação dos eletrodos implantados banhados em líquidos teciduais tem sido empregada por vários pesquisadores; os resultados a longo prazo, porém, têm sido desapontadores. 102,115.130
O Circuito Eletrônico
A força produzida pelas fontes de energia descritas acima precisa ser modificada por um circuito de cronometragem e um circuito de ativação, a fim de determinar freqüência, amplitude e duração dos impulsos. Durante as fases iniciais da eletroterapia nos séculos 18 e 19, os pulsos "abre e fecha" eram fornecidos pela aplicação manual dos eletrodos, pedais, chaves de telégrafos, botões de pressão ou interruptores manuais.134 No início de 1900, já estavam sendo utilizados vários interruptores de corrente. A freqüência dos primeiros marcapassos cardíacos era determinada por um oscilador bloqueador, ou um multivibrador estável. Mais recentemente, têm sido usados osciladores de cristal com características de rendimento mais precisas. Se a fonte de energia estivesse ligada a apenas um circuito de ativação, este seria um dispositivo assincrônico ou de freqüência fixa, incapaz de detectar o ritmo cardíaco intrínseco. O acréscimo de um circuito sensor (ou amplificador sensor) permitiu a detecção da atividade cardíaca intrínseca, através do(s) sistema(s) de eletrodo(s), a fim de proporcionar vários tipos de estimulação de demanda ou ativação atrial .20,105 Os primeiros marcapassos implantáveis utilizados na década de 60 tinham freqüência fixa e relativamente poucos componentes. Os marcapassos usados no final da década de 70 empregavam circuitos híbridos fazendo uso de poucos componentes sólidos, associados ao microcircuito, no qual os componentes equivalentes chegavam a várias centenas. Os aparelhos atuais contêm microprocessadores, que consistem no equivalente a vários milhares de componentes. As vantagens destes aparelhos são: maior eficiência do circuito com menor consumo de corrente, melhor função sensorial e rejeição de interferências, muito maior flexibilidade e segurança em termos de redundância do circuito, programabilidade externa ou automática de vários parâmetros e a possibilidade de interrogar o aparelho através da telemetria, acerca de sinais de falência iminente do sistema e dos ajustes programados existentes.
Um marcapasso europeu varia a taxa de estimulação de acordo com as alterações medidas no intervalo Q-T estimulado, refletindo a sofisticação que podem proporcionar esses circuitos de marcapasso cada vez mais complexos.123 Sem dúvida alguma, os sistemas de marcapasso futuros proporcionarão a programabilidade "biológica- automática, a fim de adaptar a função do marcapasso às necessidades fisiológicas alternantes.
Acondicionamento
"A função do meio encapsulante é conter os componentes do circuito sem estresse, fornecer apoio mecânico, servir de barreira contra umidade e ser eletricamente isolante."29
Esforços para identificar esse método durante o início da década de 60, quando o marcapasso permanente foi introduzido, enfatizavam um grupo de materiais conhecidos como sistemas de resina de epóxido, nos quais uma resina de epóxido líquida é polimerizada por um agente ativador. Esse método constituía o modo predominante de encapsulamento do gerador de pulsos, porém era também fonte freqüente de disfunção eventual. O processo de ativação dos sistemas de resina de epóxido é exotérmico, altamente vulnerável à temperatura e pressão ambientes e associado a um fator de retração de cinco a seis por cento. A permeabilidade subseqüente aos líquidos teciduais do corpo, combinada aos estresses mecânicos aplicados aos componentes eletrônicos durante o tratamento, contribuíam para as falências prematuras do gerador. 153 Alterações de volume da resina de epóxido, resultantes da absorção de umidade, acentuavam ainda mais esses estresses e, ocasionalmente, resultavam em rachadura do epóxido. A "lubrificação" externa do gerador de pulso revestido por epóxido com borracha de silicone de uso médico modificou, porém não eliminou esses problemas. Foi experimentada a soldagem elétrica dos componentes e fontes de energia no interior de uma cápsula metálica, com um aparelho alimentado com mercúrio-zinco, usado inicialmente.95
A lesão térmica dos componentes eletrônicos durante a soldagem e os efeitos compressivos do gás hidrogênio emitido pela bateria desestimularam a aplicação continuada desse método.
A introdução das fontes de energia à base de lítio, que não emitem gases, renovou o entusiasmo em torno dos encapsulamentos metálicos vedados hermeticamente, que reduzem a exposição do circuito e da bateria ao vapor dágua. A maioria dos dispositivos da atualidade possui três revestimentos; isto é, o circuito e a bateria são selados individualmente, assim como o produto final composto. A definição de hermeticidade varia de acordo com o objetivo do aparelho final e é determinada em termos de percentagem de extravasamento do hélio. Para os aparelhos eletrônicos, isso varia em torno de 10-8 a 10-10 (atm.mL)/s. Evidências experimentais sugerem que a percentagem de extravasamento do vapor d'água (assim como dos líquidos teciduais) seja 10 a 100 vezes menor do que a do hélio.29 Os dispositivos dos fabricantes diferem quanto ao material utilizado para revestir o marcapasso. O titânio evita a corrosão galvânica, embora possa causar a corrosão de um metal semelhante em contato com ele. Portanto, é preciso ter cuidado na aplicação de gerador de pulsos de um fabricante com eletrodos de outro Falhas físicas no desenho podem acarretar irritação tecidual local e expulsão do aparelho.24 A corrosão do próprio titânio não ocorre , em parte devido a sua tendência a formar uma camada autoprotetora de óxido. Seu peso leve é uma vantagem adicional. O aço inoxidável também é empregado e proporciona proteção considerável. A utilização do ácido inoxidável tipo 316L, com alto teor de molibdênio e baixo teor de carbono, diminui a corrosão. Os isoladores de vidro ou cerâmica, através dos quais se faz o contato entre o eletrodo e o circuito encapsulado, têm acarretado alguma variabilidade no comportamento dos aparelhos do passado.
Eletrodos
A via comum final de estimulação (e percepção) entre o gerador de pulsos e o coração passa pelo sistema de eletrodos. Em nenhuma outra situação a analogia com a "sintonia fina" se aplica tão bem, quanto no que se refere a esse tema. O conjunto eletrônico mais sofisticado do mundo torna-se inútil, a menos que não haja ruptura ou isolamento dos fios. A experiência inicial com os eletrodos levou ao reconhecimento de aspectos muito importantes, como a fadiga do metal e a corrosão eletrolítica resultante da interconexão de metais diferentes. A soldagem de um eletrodo monofilamentar no interior de uma mola helicoidal reduz a fadiga do metal em qualquer ponto específico e há pouca dúvida de que essa inovação contribuiu acentuadamente para o rendimento subseqüente. O estudo dos testes de fadiga comprovou as características superiores do aço inoxidável ou Elgiloy.15 Nos eletrodos bipolares, o elemento condutor consiste em molas helicoidais de aço inoxidável em série, com pontas do eletrodo de irídio-platina em disposição látero-lateral ou coaxial. Os eletrodos unipolares podem ser de aço inoxidável ou Elgiloy do princípio ao fim. A configuração dos eletrodos unipolar e bipolar está ilustrada na Figura 9-4.
As variações na disposição da extremidade endocárdica dos eletrodos unipolar e bipolar têm oferecido ao médico ampla opção na escolha desses elementos. Essas variações no desenho e formato têm sido introduzidas com vários objetivos. O acréscimo de rebordos ou estabilizadores verticais na diáfise próxima à extremidade reduz a freqüência do deslocamento. Redução da área na porção estimuladora do eletrodo aumenta a densidade de corrente, reduz o consumo de corrente e prolonga a longevidade esperada do marcapasso. As variações de distância entre os eletrodos nas derivações bipolares aumentam o dipolo, através do qual o ECG intracavitário espontâneo é registrado, dessa forma intensificando a fidelidade do amplificador sensorial. Outras inovações incluem a utilização de vários tipos de ganchos, rebarbas e espirais com o objetivo de reduzir a incidência de deslocamento subseqüente dos eletrodos.
As vantagens relativas da estimulação unipolar em comparação com a bipolar são determinadas, até certo ponto, pela preferência pessoal. Os eletrodos unipolares, em virtude de seu calibre menor, adaptam-se melhor no interior de uma veia pequena ou bainha introdutora. Por outro lado, o "efeito antena" criado pela separação do catodo unipolar no coração e o eletrodo neutro (ou anodo) no gerador do pulso, torna esses sistemas mais vulneráveis à interferência externa, através da detecção da emissões de radiofreqüência ambiental, ou da contração miopeitoral local (Fig. 9-5). A contração muscular súbita em torno do gerador, que é um problema ocasional com os sistemas unipolares, não ocorre com as unidades bipolares, na ausência de vazamentos de corrente, porém os aparelhos bipolares possuem a desvantagem de ter sistemas de derivação mais calibrosos e maior probabilidade, de acordo com estudos efetuados em animais, de contribuir para arritmias perigosas em conseqüência da chamada "imersão anódica".120 No passado, o limiar de estimulação crônica tendia a ser maior e, muitas vezes, atingia níveis inaceitáveis com os eletrodos bipolares, provavelmente em conseqüência de sua maior área. Embora as diferenças ainda persistam, inovações recentes na tecnologia dos eletrodos têm reduzido o intervalo entre os limiares unipolar e bipolar.
Tipos de Marcapasso
Durante os últimos 30 anos, os marcapassos têm sido aperfeiçoados dos estimuladores ventriculares de freqüência fixa relativamente simples, até unidades eletrônicas complexas que oferecem vários tipos de sensibilidade e estimulação ventricular e atrial. Esses dispositivos novos possuem circuitos lógicos sofisticados, que podem ser programados para alterar os modos e parâmetros da estimulação, através de sinais de radiofreqüência ou eletromagnéticos do exterior do corpo. Na verdade, uma dessas unidades pode ser programada para mais de 150 trilhões de combinações. Além disso, alguns aparelhos têm a capacidade de detectar e interromper taquiarritmias por estimulação competitiva, cardioversão ou desfibrilação interna. Considerando a complexidade dos marcapassos atuais, o médico defronta-se com a grandiosa tarefa de compreender a tecnologia nova e determinar sua aplicação adequada.
Códigos do Marcapasso
Para simplificar a comunicação e facilitar a identificação dos sistemas de marcapassos, a American Heart Association adotou um código de letras em cinco grupos (Quadro 9-2). Cada posição descreve um aspecto diferente do rendimento do marcapasso. A primeira posição designa as câmaras cardíacas estimuladas. A indica átrio, V ventrículo e D dupla (átrio e ventriculo). Ocasionalmente, pode-se encontrar a letra S (simples), que é usada pelos fabricantes para descrever os aparelhos adequados à estimulação ventricular ou atrial. A segunda posição identifica as câmaras específicas analisadas sensorialmente. Mais uma vez, as letras A, V e D são usadas (átrio, ventrículo ou dupla), porém a letra O designa as unidades que não têm capacidade sensorial ou descreve as circunstâncias nas quais o circuito sensorial foi inativado pela programação.
A terceira posição define a resposta do marcapasso aos fenômenos percebidos. Percepção de despolarização cardíaca intrínseca inibe (I) ou desencadeia (T) a ativação do marcapasso e reajusta o circuito de ritmo. Se o circuito sensorial tiver sido inativado, não haverá resposta e a letra O é usada. Nos aparelhos de câmaras duplas, a letra D (dupla) significa respostas de inibição e desencadeamento. Neste caso, o canal ventricular é inibido pela atividade ventricular percebida (ondas R), porém desencadeado pelas despolarizações atriais espontâneas ou estimuladas (ondas P), após um retardo atrioventricular pré-ajustado. Dessa forma, o sincronismo atrial é mantido, e a competição ventricular evitada (ver abaixo). R (reverso) na terceira posição tem sido usado para identificar um marcapasso que é inibido pelo ritmo sinusal normal e bradicardia, porem que estimula em resposta às taquiarritmias. As três posições descritas acima (estimulação, percepção e resposta) são utilizadas mais comumente para definir a função do marcapasso. Contudo, a quarta e quinta posições existem para descrever características adicionais.
A programabilidade, ou capacidade de alterar o rendimento do marcapasso através da interação não invasiva externa, é especificada na quarta posição. A programação é conseguida pela transmissão transcutânea de sinais magnéticos ou de radiofreqüência codificados até um receptor no interior do gerador de pulsos. A letra P significa marcapassos que possuem capacidade de programação simples, limitada a freqüência e/ou ativação. O indica as unidades que não possuem programabilidade. M (multiprogramável) descreve aparelhos com capacidade de alterar vários parâmetros, como modo de operação, sensibilidade, período refratários, histeresia, polaridade e duração do pulso, além da freqüência e ativação. De forma semelhante à programação, alguns aparelhos multiprogramáveis transmitem ou telemetrificam informação de volta ao programador externo. A telemetria é indicada pela letra C (comunicação) na quarta posição. Habitualmente, dados recebidos pela telemetria, como condições da bateria ou parâmetros programados, descrevem a condição funcional do gerador de pulsos. Os dispositivos mais novos, contudo, têm a capacidade de "relatara atividade cardíaca intrínseca, como despolarizações ventriculares prematuras, percentagem de batimentos estimulados e eletrogramas ventriculares e atriais intracardíacos. Além disso, dados clínicos, como medicamentos e patologia coexistentes, podem ser armazenados, atualizados e recuperados do circuito de memória especial. A quinta posição significa a resposta antitaquicardia. B indica estimulação repetida sob freqüência e duração pré-determinadas. S denota modo de rastreamento. Nesse modo, o marcapasso libera uma série inicial de estímulos. Se essa tentativa não consegue interromper a taquiarritmia, as durações dos cicios das séries subseqüentes são automaticamente diminuídas. Dessa forma, a diástole é rastreada para se encontrar os intervalos de interrupção adequados. Finalmente, E (de externo) descreve um gerador de pulsos que responde aos sinais recebidos de um transmissor fora do paciente. O transmissor é pré-ajustado para liberar estímulos adequados para cada indivíduo.
Esse código estabelece a linguagem para comunicação entre engenheiros, fabricantes e médicos. Sua vantagem consiste na simplicidade, concisão e possibilidade de descrever a maior parte da tecnologia atual acerca dos estimuladores cardíacos implantáveis. Têm sido descritos código alternativos, que proporcionam informação mais específica sobre o rendimento de cada câmara. 18
Modos de Função do Marcapasso
Estimulação de Câmara única
ESTIMULAÇÃO ASSINCRÔNICA (VOO, AOO, DOO). Em 1958, os primeiros geradores de pulso implantáveis continham apenas circuitos de ritmicidade e ativação. 22,36 Tais unidades eram descritas como de freqüência fixa ou assincrônicas, já que estimulavam os ventrículos com freqüência pré-determinada, independentemente do ritmo cardíaco intrínseco (Fig. 9-6). Em geral, esses dispositivos funcionavam muito bem na profilaxia dos sintomas associados à bradicardia, porém tinham a desvantagem da competição ventricular (Fig. 9-7)113
Em presença de atividade cardíaca espontânea, os estímulos dentro do período refratário efetivo (PRE) são ineficazes, enquanto que os ocorridos durante a fase excitatória normal causam despolarização. Essa competição elétrica pode acarretar um ritmo de certa forma caótico, sentido pelo paciente como palpitações. Mais preocupante é a possibilidade de que a estimulação durante o denominado período vulnerável - a fase de repolarização corresponde às ondas T sobre o ECG de superfície - possa induzir arritmias perigosas.12 Apesar das preocupações teóricas e dos relatos de casos documentando esse fenômeno, pesquisas clínicas extensas não conseguiram confirmar um aumento da taxa de mortalidade nos pacientes com marcapassos de freqüência fixa, em comparação com pacientes com unidades de demanda. Devido a palpitações incômodas e à preocupação acerca das arritmias, especialmente em presença de cardiopatia isquêmica, a estimulação assincrônica atualmente é utilizada em casos raros. No entanto, a estimulação com freqüência fixa pode ser preferível em algumas circunstâncias, especialmente quando sinais ambientais ou extracardíacos puderem inibir a estimulação de demanda atrial ou ventricular não-competitiva inibida (AAI, VVI).
Em virtude dos problemas reais ou potenciais associados à estimulação com freqüência fixa ou competitiva, os geradores de pulsos foram modificados no início da década de 60 pelo acréscimo de um circuito sensorial.20 Esse tipo de estimulação, denominada de demanda ou não-competitiva, utiliza como sensor o eletrodo implantado, assim como o estimulador. Neste caso, a atividade cardíaca espontânea inibe a liberação do pulso e reajusta o circuito de ritmicidade. Portanto, o gerador de pulsos funciona apenas segundo a demanda, quando a freqüência cardíaca cai abaixo da freqüência de estimulação pré-ajustada (Fig. 9-8). A histeresia pode ser acrescentada em alguns marcapassos e permite à freqüência cardíaca cair significativamente abaixo da freqüência de estimulação programada, antes da ativação do marcapasso (Fig. 9-9). Utilizando-se essa abordagem, o ritmo intrínseco e o sincronismo AV do paciente são preservados até uma freqüência de escape menor, embora ocorra freqüência cardíaca mais acelerada durante a estimulação ventricular.
A capacidade de detectar despolarizações espontâneas e diferenciar a atividade cardíaca dos outros estímulos eletromagnéticos é fundamental ao funcionamento adequado dos marcapassos não-competitivos. Progressos recentes na tecnologia dos eletrodos têm produzido melhores propriedades de fixação, a fim de aumentar a estabilidade e melhorar os potenciais dos sinais endocárdicos. Pode-se esperar um potencial endocárdico registrado de 5 a 20 mV nos eletrodos ventriculares e de 2 a 5 mV nos atriais. A maioria dos geradores de pulsos implantáveis possui sensibilidades programáveis e rejeita potenciais de sinais abaixo de seus ajustes programados. A sensibilidade programável adapta-se às necessidades individuais e possibilita a monitorização do médico, a fim de melhorar a relação sinal-ruído. Outras propriedades eletrônicas são usadas para diferenciar a ativação das câmaras cardíacas dos sinais estranhos. Filtros, por exemplo, rejeitam estímulos eletromagnéticos fora da variação da freqüência cardíaca esperada (aproximadamente 40 a 60 Hz). Além disso, a taxa de elevação no tempo do potencial do sinal endocárdico (dv/dt) (denominada taxa de giro) é importante para o reconhecimento dos sinais. Na verdade, tem sido relatada falência ocasional da sensibilidade, apesar da amplitude adequada dos sinais, em virtude de deflexão QRS intracavitária atenuada.53
Percepção indesejável da atividade intracardíaca, como ondas T na estimulação ventricular (Fig. 9-10), ou deflexão QRS na estimulação atrial (Fig. 9-11), é evitada pelo ajuste do período refratário do marcapasso. Esse período de sensibilidade/período refratário do marcapasso é análogo ao período refratário do coração para os estímulos do aparelho. Depois que houver um evento estimulado ou percebido, o circuito sensorial do marcapasso será inativado (refratário) para um intervalo de tempo pré-ajustado. Esse intervalo é programável em muitos geradores de pulsos.
ESTIMULAÇÃO SINCRÔNICA OU REGULADA (AAT, VVT). A profilaxia das arritmias competitivas também pode ser conseguida pela liberação dos estímulos do marcapasso durante o período refratário absoluto do coração. 104 Como ocorre com o marcapasso inibido, eventos percebidos ou estimulados reajustam o circuito de ritmicidade. Ouando não houver ritmo endógeno ou a freqüência cair abaixo da freqüência pré-ajustada do marcapasso, o dispositivo estimulará e fará a captura da câmara cardíaca (Fig. 9-12). Se o ritmo espontâneo retornar, o marcapasso novamente sincronizará o artefato do estímulo ineficaz com a despolarização cardíaca intrínseca. O ECG resultante pode parecer confuso, já que os estímulos do marcapasso são observados com todo os complexos, com exceção daqueles no interior do período refratário do dispositivo, que é necessário para evitar o sincronismo das ondas T. Os complexos espontâneos que ocorrem durante o período refratário do marcapasso, portanto, não conseguirão disparar o aparelho e parecerão ter sido "perdidos". Já que podem ocorrer várias combinações de sincronismo alternado (Fig. 9-13), é preciso tomar cuidado para evitar a interpretação desses eventos como disfunção.
Estimulação de Câmaras Duplas
O reconhecimento do sincronismo AV data da época de Galeno (131-201 a.C.), que observou os batimentos seqüenciais dos átrios e ventrículos. A importância da contração atrial como determinante do volume ejetado e do efeito das alterações na freqüência cardíaca sobre o débito cardíaco tem sido reconhecida de longa data. A maioria dos marcapassos de câmaras duplas não tem qualquer meio de variar a freqüência cardíaca em resposta às alterações nas necessidades metabólicas, e os marcapassos ventriculares simples não permitem a coordenação das contrações atriais e ventriculares.
A conveniência da utilização da atividade atrial espontânea para desencadear a estimulação ventricular foi reconhecida, mesmo antes que os sistemas de marcapassos temporários eficazes ou implantáveis estivessem disponíveis.48 Necessidades de um sistema duplo, com um eletrodo no átrio e outro no ventrículo, por também exigirem circuitos mais complexos, retardavam a aplicação generalizada dessa técnica fisiológica. Progressos recentes na tecnologia dos eletrodos e dos circuitos baseados em microprocessadores possibilitaram a produção de dispositivos de câmaras duplas confiáveis.
ESTIMULAÇÃO ATRIOVENTRICULAR SINCRÔNICA, SINCRÔNICA COM ONDAS P, OU VENTRICULAR DESENCADEADA POR ONDAS P (VAT/VDD). Na estimulação VAT, o gerador de pulsos "sente" a atividade atrial espontânea e estimula os ventrículos após um retardo AV programado.105 À medida em que a freqüência sinusal varie em resposta às necessidades metabólicas, a freqüência da estimulação ventricular também varia, mantendo o sincronismo AV pré-ajustado e programado. Se houver taquiarritmias supraventriculares, o circuito do marcapasso efetua, automaticamente, o bloqueio AV a fim de manter a freqüência ventricular em faixa aceitável. Na ausência de atividade atrial, o dispositivo retorna a estimulação ventricular sob freqüência básica programada. Em aparelhos mais recentes, também é utilizado um amplificador sensorial ventricular (VAT + VVI = VDD), para evitar competição ventricular (Fig. 9-14). Esse tipo de estimulação é adequado aos pacientes que têm bloqueio AV em presença de um mecanismo sinusal fisiológico. Pacientes com flutter atrial, fibrilação atrial ou disfunção do nódulo sinusal e freqüências sinusais lentas, não obterão benefícios fisiológicos com esses aparelhos, já que eles funcionarão apenas como uma unidade de demanda ventricular mais convencional (VVI), ou desencadeada pela arritmia atrial.
ESTIMULAÇÃO SEQÜENCIAL ATRIOVENTRICULAR (DVI, DOO). A estimulação seqüencial dos átrios e ventrículos com retardo AV pré-ajustado possibilita a recuperação da transmissão atrial coordenada nos pacientes com atividade sinusal lenta ou ausente. Nesse tipo de estimulação, a atividade ventricular "sentida" inibe a liberação dos pulsos de ambos os canais. Ao contrário da estimulação sincrônica AV (VDD), não há resposta desencadeada pelo átrio e os aparelhos DVI não possuem qualquer meio de variar a freqüência cardíaca, em resposta às necessidades metabólicas. Portanto, a estimulação seqüencial AV (DVI) é menos fisiológica do que a estimulação sincrônica AV (VDD), tanto quanto a variação da freqüência, porém ela pode proporcionar um aumento significativo no débito cardíaco, em comparação com a estimulação ventricular isolada (VVI), através da recuperação do sincronismo AV. 32,43,69,89
A "comunicação cruzada- é um problema potencial com a estimulação de câmaras duplas. Isso ocorre quando o estímulo liberado por um canal é sentido pelo outro. Por exemplo, o amplificador sensorial ventricular pode inibir sua ativação ventricular, através da interpretação do artefato do marcapasso atrial como uma despolarização ventricular intrínseca (Fig. 9-15). Em presença de bloqueio cardíaco completo, podem ocorrer resultados desastrosos com a estimulação atrial consecutiva, porém com a ventricular ausente. Alguns geradores de pulso DVI são "totalmente comprometidos" e, nesses sistemas, a liberação atrial é sempre seguida da estimulação ventricular, independentemente da atividade ventricular intrínseca. Portanto, existe a possibilidade da competição ventricular, à medida que o amplificador sensorial ventricular for desativado entre os estímulos atriais e ventriculares.
Marcapassos "parcialmente comprometidos" permitem rápida "sensibilização" ventricular, durante o intervalo AV, porém têm uma zona "em branco" que coincide com a descarga do estímulo atrial. A duração desta zona em branco varia entre os dispositivos e define um intervalo de tempo, que coincide com a estimulação atrial durante a qual o amplificador sensorial ventricular está inativado. A atividade ventricular espontânea que ocorre depois do período "em branco é sentida e a liberação ventricular será inibida. A despolarização ventricular espontânea que coincide com a estimulação atrial, contudo, será ignorada e o pico da estimulação ventricular poderá ser observado no QRS ou segmento S-T do ECG. A maioria dos aparelhos de estimulação de câmaras duplas utiliza essa tecnologia parcialmente comprometida reduzindo, porém não eliminando, a probabilidade de competição ventricular. Os eletrodos bipolares com seus dipolos relativamente estreitos diminuem a denominada "sensibilidade a distância" e reduzem a comunicação cruzada. Progressos nos cabos coaxiais e conectores "em linha" têm possibilitado o desenvolvimento de aparelhos bipolares menores e mais práticos.
Devido à ausência de sensibilidade atrial na estimulação DVI, a competição atrial também pode ocorrer quando a freqüência atrial intrínseca se aproxima ou ultrapassa a freqüência de estimulação programada. Essa freqüência atrial mais rápida pode ocasionar graus variáveis de dissociação AV e atenuar as vantagens hemodinâmicas da estimulação DVI de câmaras duplas (Fig. 9-16). Além disso, a competição com a atividade atrial normal pode provocar arritmias, como fibrilação atrial com perda adicional da função de transmissão atrial.50 No entanto, os sistemas de marcapasso seqüencial AV podem ser úteis, principalmente em casos de bradicardia sinusal persistente ou parada sinusal, quando a competição atrial for improvável.
ESTIMULAÇÃO UNIVERSAL ATRIOVENTRICULAR SEQÜENCIAL E SINCRÔNICA ATRIOVENTRICULAR (DDD). Os dispositivos de câmaras duplas descritos acima possuem vantagens hemodinâmicas individuais e nítidas em relação aos marcapassos ventriculares de câmara única (VVI). Unidades sincrônicas AV (VDD) possibilitam a preservação da transmissão e possibilidade de resposta da freqüência atrial em presença de bloqueio AV e freqüências sinusais "fisiológicas". Dispositivos seqüenciais AV (DVI) permitem a transmissão atrial coordenada, em presença de bradicardia ou parada sinusal, porém não possibilitam variação fisiológica na freqüência. O desenvolvimento mais recente dos marcapassos universais AV (DDD) proporciona sincronismo AV sensível à freqüência, embora mantenha a estimulação seqüencial AV à medida que a freqüência atrial diminui abaixo de um limite inferior programável (Fig. 9-17). Circuitos sensoriais e de ativação estão presentes nos canais atriais e ventriculares e estão integrados por um circuito lógico. Na estimulação DDD, os átrios e ventrículos são monitorizados continuamente para a ocorrência de despolarização espontânea. A atividade atrial intrínseca inibe a ativação dos átrios, reajusta o circuito de ritmicidade e ativa o contador de intervalo AV. Em presença de condução normal, a ativação ventricular também é inibida e os ciclos de ritmicidade são novamente reajustados.
Se o ventrículo não consegue despolarizar-se dentro do intervalo de retardo AV programado, haverá um estímulo ventricular. Se nenhuma atividade atrial é percebida dentro do período adequado (esgotamento ventrículo-atrial), o circuito de ativação atrial dispara e ativa o contador do intervalo AV. Dessa forma, o marcapasso acompanha rigorosamente os eventos cardíacos intrínsecos e proporciona estimulação adequada, quando há falência da atividade espontânea dos átrios, ventrículos ou ambos.
O desenvolvimento dos marcapassos baseados em microcircuitos e microprocessadores com telemetria tem facilitado esse método "fisiológico" de estimulação. Os geradores de pulsos atuais permitem a programação das freqüências máxima e mínima, retardo AV e modo de operação, além da sensibilidade, energia liberada e períodos refratários dos canais atriais e ventriculares. Na verdade, o número de alterações exeqüíveis nas características de rendimento para determinada intervenção de programação pode ultrapassar 10 quintilhões. Através da interação em radiofreqüência com o programador, informações podem ser recebidas do aparelho implantado. Habitualmente, essas informações descrevem os ajustes programados, porém também podem indicar a atividade cardíaca intrínseca, como o número de despolarizações ventriculares prematuras e a percentagem de batimentos estimulados durante um intervalo precedente. Algumas unidades transmitem eletrogramas intracardíacos e marcam os canais, a fim de ajudar na interpretação do ECG. Além disso, dados clínicos ou biográficos podem ser armazenados no circuito de memória, para utilização subseqüente.
Embora os marcapassos de câmaras duplas da atualidade pareçam ser maravilhas tecnológicas, ainda existem alguns inconvenientes. Nos sistemas unipolares populares, o problema da comunicação cruzada ainda requer períodos "em branco" durante os quais uma despolarização espontânea pode passar despercebida, criando o potencial para competição ventricular. Condução ventrículo- atrial retrógrada é outro problema possível com os marcapassos VDD e DDD. Despolarização ventricular espontânea ou estimulada pode ocorrer na condução retrógrada através do sistema de HisPurkinje, ou de uma via acessória, despolarizando os átrios (Fig. 9-18). Cinqüenta a 60% de todos os pacientes que precisam de estimulação ventricular podem ter condução ventrículo-atrial. Isso ocorre em até 85% dos pacientes com síndrome do nodo sinusal doente.159 Na verdade, 15% dos indivíduos com bloqueio cardíaco anterógrado completo apresentam condução ventrículoatrial. A ativação atrial retrógrada, que ocorre durante a estimulação VVI, pode estar associada a hipotensão e diminuição do débito cardíaco, ou à denominada síndrome do marcapasso (ver Fisiologia da Estimulação Cardíaca). Em um dispositivo de câmaras duplas, a percepção de onda P retrógrada desencadeia resposta ventricular estimulada, que pode gerar ainda outra despolarização atrial retrógrada. Dessa forma, pode instalar-se uma taquicardia no limite superior de freqüência do aparelho (Fig. 9-19). Na verdade, o circuito do marcapasso atua como via de derivação eletrônica. Clinicamente, essas taquicardias relacionadas ao marcapasso são iniciadas, em geral, por despolarizações ventriculares prematuras, embora a detecção da contração miopeitoral ou a aplicação de um ímã possa ser o evento desencadeante.66 Paradoxalmente, um ímã aplicado externamente sobre o gerador de pulsos inativará o circuito sensorial e interromperá a taquicardia. O marcapasso poderá ser, então, reprogramado para um período refratário atrial mais longo, a fim de evitar a percepção da atividade retrógrada subseqüente. Contudo, a dilatação do período refratário atrial limita a freqüência de rastreamento atrial superior do marcapasso, que é determinada pela soma do período refratário atrial pós-ventricular e do intervalo AV programado (Fig. 9-20). Outros métodos de controlar a taquicardia provocada pelo marcapasso são a dilatação automática do período refratário, após um complexo ventricular prematuro e a programação de intervalo AV curto, a fim de aumentar as refratariedades nodal e atrial retrógradas intrínsecas. Algoritmos complexos que permitam a detecção da excitação anterógrada, porém não retrógrada, poderão ser componentes dos sistemas de câmaras duplas do futuro.
Apesar dos progressos recentes na tecnologia dos eletrodos, a estimulação DDD ainda é limitada, ocasionalmente, pela instabilidade do eletrodo atrial ou pelos sinais endocárdicos atriais de pouquíssima intensidade. Em nossa experiência, que já chega a cerca de 1.000 DDD implantados, aproximadamente 10% dos pacientes apresentam falência intermitente na detecção de ondas P ocasionais durante o acompanhamento telefônico padronizado, embora isso raramente tenha significado clínico. Isso é particularmente verdadeiro durante as primeiras semanas após a implantação, quando o limiar transitório eleva-se e há diminuição da potência do sinal. O progresso na produção de eletrodos de configuração diferente e eletrodos de elução esteróide pode significar um aperfeiçoamento nessa área.
Outro inconveniente dos sistemas de marcapasso DDD atuais é sua impossibilidade de variar a freqüência cardíaca em presença de bradicardia sinusal persistente (insuficiência cronotrópica). Considerando-se a necessidade de detecção atrial para a ativação da freqüência de estimulação ventricular, não haverá aumento da freqüência cardíaca, se os átrios não responderem ao estresse. Nessas circunstâncias será necessário algum tipo de sensor metabólico ou biológico para modular as freqüências de estimulação atriais. Vários tipos de sensores para dispositivos de câmaras simples têm sido investigados, incluindo-se monitores de freqüência respiratória, intervalos Q-T, pressão arterial, pH, PO2, temperatura e atividade muscular. Esses aparelhos não são mais do que projeções de engenharia. Vários milhares de implantes de marcapassos com detector respiratório ou Q-T têm sido efetuados na Europa, embora o dispositivo de detecção da atividade do Medtronic tenha obtido a distinção de ser o marcapasso de câmara única mais comumente prescrito no mundo. Ainda que esses dispositivos possam produzir melhoras rápidas no débito cardíaco e duração do esforço, eles não são realmente "fisiológicos" no sentido habitual dessa palavra. Sua utilização é mais adequada para pacientes com fibrilação atrial crônica e bradicardia fixa. Grande parte dessa tecnologia será introduzida como sensores para dispositivos de câmaras duplas, nos quais a modulação da freqüência atrial programada será mais próxima da resposta cardiovascular normal ao estresse.
Finalmente, o custo tem se tornado consideração importante na estimulação com marcapasso de câmaras duplas. Os custos médios da implantação do marcapasso DDD são de US$ 1.500 a US$ 2.000 a mais do que para uma unidade de câmara única programável simples - esses custos chegariam a US$ 200 milhões, anualmente, se fossem aplicados a todos os receptores de marcapasso.34 Considerando-se as limitações de recursos da assistência à saúde, é cada vez mais importante que o médico que prescreve tais dispositivos analise, cuidadosamente, os benefícios potenciais de cada aparelho marcapasso disponível nas situações clínicas específicas optando por um dispositivo mais complexo e dispendioso somente quando este oferecer ao paciente vantagem inquestionável. Apesar dos benefícios hemodinâmicos consideráveis com os aparelhos de câmaras duplas, os sistemas de câmaras simples menos sofisticados ainda têm função importante.
Marcapasso Antitaquicardia
Embora a eficácia da estimulação cardíaca no tratamento da bradicardia tenha sido bem documentada e seja amplamente aceita pelos médicos, a função da estimulação elétrica no controle das taquiarritmias ainda não está claramente definida. Vários estudos têm demonstrado a utilidade da estimulação extenuante na profilaxia das taquiarritmias e outros têm descrito a potencialização dos agentes antiarrítmicos tipo IA dependente da freqüência. No entanto, a utilização a longo prazo de marcapassos convencionais na profilaxia das disritmias tem sido desapontadora.
Entretanto, a estimulação elétrica aproximadamente ritmada tem sido eficaz na interrupção das arritmias atriais e ventriculares.82,164 Dois tipos de estimulação têm sido utilizados - "rastreamento" e "seriada". Nesta última, uma série assincrônica rápida de impulsos é liberada, na tentativa de penetrar e interromper o circuito da taquicardia reentrante. Essa técnica pode ser aplicada utilizando-se um eletrodo de estimulação transvenosa temporário, ou eletrodos epicárdicos temporários, após cirurgia cardíaca. Ela é particularmente útil em pacientes com arritmias atriais estabelecidas, nos quais o tratamento farmacológico fracassou ou que têm contra-indicações relativas para a cardioversão, como possível toxicidade digitálica. Períodos rápidos de estimulação (1 a 3 segundos), começando na freqüência de 125% da taquicardia, parecem ser mais eficazes. 161,162 Vários tipos de dispositivos de estimulação seriada implantáveis têm sido usados no tratamento crônico da taquicardia supraventricular. Um deles utiliza uma espiral e eletrodo receptor subcutâneo, que transmitem os impulsos induzidos derivados de um dispositivo externo ativado pelo paciente e colocado sobre o implante.127 Os aparelhos mais modernos detectam automaticamente a taquicardia, disparam uma série programada e, então, monitorizam a atividade atrial. Se a taquicardia persiste, a série é repetida. Se a taquicardia desaparece, porém não é detectada qualquer atividade atrial, a estimulação atrial (AAI) é iniciada na freqüência pré-ajustada, até que o ritmo sinusal seja reiniciado (Fig. 9-21). A duração e o comprimento dos ciclos seriados adequados são determinados na época do exame eletrofisiológico invasivo e podem ser alterados pela reprogramação, de acordo com a necessidade.45
Marcapassos rastreadores** detectam a taquicardia e estimulam a intervalos pré-determinados, após a despolarização espontânea, na tentativa de penetrar a fase vulnerável do ciclo cardíaco e, dessa forma, tornar refratária uma parte do circuito de reentrada. Podem ser aplicados estímulos isolados ou múltiplos, com intervalos de comprimento variável. Se a taquicardia não regredir após uma seqüência de estimulação inicial, o dispositivo reduzirá automaticamente o comprimento do ciclo em uma taxa pré -determinada. Dessa forma, o marcapasso continuará reciclando e "rastreando" a diástole com impulsos, até que a arritmia seja interrompida. Mais uma vez, o número adequado de estímulos e os intervalos eficazes são programados de acordo com estudos eletrofisiológicos prévios. Algumas unidades são capazes de "relembrar" parâmetros bem-sucedidos anteriormente e iniciar a estimulação subseqüente com estes intervalos. Atualmente, os marcapassos antitaquicardia implantáveis têm sido limitados, em grande parte, ao tratamento das arritmias atriais. Embora comumente sejam utilizadas técnicas semelhantes no laboratório de eletrofisiologia para iniciar e interromper a taquicardia ventricular, essa estimulação pode acelerar a taquicardia ou provocar fibrilação ventricular. A aplicação generalizada desses dispositivos no tratamento das taquicardias ventriculares recorrentes e resistentes aos medicamentos dependerá do desenvolvimento da capacidade desfibrilatória automática, além dos mecanismos de estimulação auxiliares.
Desfibrilador-Cardioversor Interno Automático (DCIA)
Até o momento, nenhuma modalidade de estimulação com marcapasso tem sido plenamente satisfatória para as arritmias ventriculares potencialmente fatais e, em geral, a primeira opção terapêutica envolve o tratamento farmacológico orientado de acordo com os resultados do exame eletrofisiológico, ou da monitorização não-invasiva repetida (ver Capítulo 7). Contudo, um número significativo de pacientes não é controlado pelos medicamentos ou desenvolve efeitos colaterais incapacitantes. As alternativas terapêuticas, inclusive a cirurgia, podem ser úteis, porém são limitadas pela morbidez, mortalidade e custo.
Mirowski e colaboradores97 desenvolveram um dispositivo elétrico implantável, que efetua automaticamente a cardioversão ou desfibrilação das arritmias ventriculares potencialmente fatais. A unidade pode usar um eletrodo epicárdico ou ventricular direito bipolar, para detectar e aplicar descargas elétricas de 25 a 30 joules, entre uma bobina transvenosa situada na veia cava superior e uma placa apical epicárdica, ou entre dois eletrodos de placas colocados sobre o epicárdio do ventrículo esquerdo. Até o momento, os resultados têm sido encorajadores, com redução significativa da mortalidade anual esperada para esses pacientes. Os problemas incluem dimensão e peso da unidade, necessidades energéticas relativamente elevadas para a desfibrilação (mais de 100 vezes maior do que para a estimulação com marcapasso), esgotamento rápido da fonte de energia (quando for necessária a cardioversão ou desfibrilação freqüente) e dificuldade em diferenciar a taquicardia ventricular lenta da taquicardia sinusal fisiológica. Além disso, é preciso considerar a morbidez da toracotomia e os custos do aparelho. (Para uma discussão mais detalhada sobre uso e indicações do DCIA, ver Capítulo 7.) Novos sistemas de eletrodos transvenosos, assim como circuitos e fontes de energia mais aperfeiçoados, estão sendo investigados e poderão eliminar algumas dessas desvantagens. Em termos ideais, o marcapasso antitaquicardia definitivo será pequeno e totalmente transvenoso e rastreará ou disparará séries de estímulos, a fim de converter a taquicardia, embora conservando o potencial de cardioverter ou desfibrilar o coração, ser for necessário.
Fisiologia do Marcapasso Cardíaco
Bradicardia intensa com início repentino causa redução acentuada no débito cardíaco, que pode evidenciar-se clinicamente por episódios parciais ou totais de síncope. Episódios recorrentes dessa natureza constituem a síndrome que leva o epônimo da doença de Morgagni-Adams-Stokes. 75
Bradicardia crônica devido a bloqueio cardíaco pode acarretar o óbito do paciente por insuficiência cardíaca, assistolia ou desenvolvimento de ritmos ectópicos instáveis. Em pacientes com bradicardia crônica, há várias alterações hemodinâmicas e anatômicas do sistema cardiovascular, todas bem documentadas no laboratório de cateterização.9,17 Primeiramente, há aumentos nas pressões sistólicas máximas sistêmica e pulmonar, com elevações concomitantes nas resistências vasculares pulmonar e sistêmica. A pressão atrial média também aumenta. Em segundo lugar, o débito cardíaco global diminui, apesar do aumento do volume ejetado, que não pode compensar plenamente a intensa diminuição no débito cardíaco. Finalmente, embora haja um aumento do volume diastólico devido ao prolongamento do período de enchimento diastólico, a pressão telediastólica do ventrículo geralmente permanece normal, até que haja insuficiência.
Junto a essas alterações fisiológicas, há alterações anatômicas secundárias. A curto prazo, o coração dilata-se em resposta ao aumento da carga diastólica. Isso é seguido pela hipertrofia cardíaca. Finalmente, contudo, a insuficiência cardíaca desenvolve-se quando esses mecanismos compensatórios não mais conseguem compensar a bradicardia persistente.
Mesmo antes do início da insuficiência ventricular estabelecida, a reserva cardíaca está reduzida e a capacidade de responder ao estresse está em seu limite.9 Em freqüências cardíacas lentas ou fixas, o débito cardíaco pode ser aumentado somente pela elevação no volume ejetado. Esse mecanismo depende do aumento do retorno venoso, elevação das catecolaminas circulantes, redução da resistência vascular periférica e intensificação do estado inotrópico do miocárdio. Quando a função miocárdica estiver prejudicada, o aumento no volume ejetado compensará apenas parcialmente a incapacidade de acelerar a freqüência cardíaca.
Fisiologia da Estimulação com Freqüência Fixa
O mecanismo de estimulação mais comumente empregado - VVI - funciona com uma freqüência pré-determinada que elimina parcialmente os efeitos deletérios da bradicardia persistente, através da elevação da freqüência cardíaca e, em geral, também do débito cardíaco. A freqüência ideal para a estimulação ventricular varia acentuadamente de paciente para paciente. Benchimol e associados observaram que a freqüência ideal de estimulação nos pacientes estudados durante o esforço está entre 62 e 93 bpm (média de 76 bpm).9 Escher e colaboradores demonstraram um índice cardíaco máximo em um grupo de 16 pacientes, com freqüências entre 60 e 70 bpm, embora alguns indivíduos continuassem tendo aumentos até freqüências entre 100 e 120 bpm.41 A previsão da freqüência de estimulação ideal é difícil a nível individual. Além disso, embora praticamente normalizem a freqüência cardíaca, os sistemas de marcapasso ventriculares convencionais não conseguem reproduzir as variações fisiológicas que ocorrem com os sistemas de condução intactos. O aumento imediato na freqüência cardíaca, que ocorre com a colocação do marcapasso pode, em alguns pacientes, desencadear isquemia miocárdica resultante de desequilíbrio entre perfusão coronariana e aumento do consumo miocárdico de oxigênio. Todos esses problemas reforçam a necessidade de se conseguir variar a freqüência da unidade de marcapasso, em resposta ao estresse fisiológico. Essa possibilidade de simular variações fisiológicas da freqüência cardíaca pode ser mais desejável nos pacientes jovens, ativos e vigorosos.
Marcapassos de Câmara única com Frequência Variável
Têm sido desenvolvidos marcapassos auto-ajustáveis, que utilizam vários sensores eletrocardiográficos e biológicos para alterar a freqüência de estimulação ventricular automaticamente. 3,19.87,122,125,140,168 Rickards e associados 122,123 descreveram um sistema que regula a freqüência da estimulação ventricular em resposta às alterações no intervalo Q-T que, intrinsecamente, parece ser um marcador sensível aos níveis de catecolaminas circulantes. Outros sistemas teóricos utilizam sensores biológicos capazes de determinar o pH,19 PO2,168 temperatura87 e respiração.125 Tais sistemas têm a vantagem técnica de utilizar apenas um único eletrodo ventricular e satisfazer aqueles que consideram o aumento do débito cardíaco em resposta ao exercício como resultado, predominantemente, da aceleração da freqüência. Esses dispositivos ignoram os benefícios adicionais consideráveis do sincronismo AV.
Um marcapasso com "freqüência ajustável" que tem sido amplamente utilizado é o aparelho Medtronic Activitrax. Essa unidade de câmara única regula a freqüência de estimulação para cima e para baixo, em resposta às alterações da postura corpórea, que são detectadas através de um cristal piezoelétrico incorporado ao circuito. Para pacientes com fibrilação atrial crônica e bradicardia constante, esse e outros dispositivos ativados por sensor conseguem modificar a freqüência em resposta ao estresse. Para qualquer paciente que apresente ritmo sinusal intermitente, existe o risco de haver condução ventrículo -atrial durante a estimulação ventricular, que pode eliminar quaisquer benefícios da variação de freqüência (Fig. 9-22).
Função do Sincronismo Atrioventricular
A contração atrial seqüencialmente adequada produz vários efeitos benéficos bem comprovados sobre a função ventricular. Utilizando diversos métodos invasivos e não-invasivos, muitos pesquisadores têm observado um aumento de 10 a 40% no débito cardíaco com estimulação AV ou atrial, em comparação com a estimulação ventricular na mesma freqüência. 89,120a,129 os motivos para esse aumento são vários. Primeiramente, a contração atrial coordenada possibilita o fechamento oportuno das valvas AV e, portanto, reduz a regurgitação valvar que é comum na dissociação AV. Em segundo lugar, a contração atrial esvazia quase totalmente os átrios, reduz a pressão atrial média e, portanto, facilita o retorno venoso. Mais importante ainda é que a contração atrial favorece o enchimento ventricular, elevando, dessa forma, a pressão telediastólica e a pré-carga no período pré-sistólico imediato. O ventrículo, portanto, é colocado em posição mais favorável na curva de função ventricular, sem a sobrecarga da elevação da pressão média durante toda a diástole. A força contrátil do ventrículo é aumentada, assim como o volume ejetado.
A ritmicidade inadequada das contrações atrial e ventricular também produz vários efeitos deletérios.58 A perda da contribuição atrial para o enchimento ventricular pode ser crítica nos pacientes com complacência diastólica anormal, assim como nos portadores de cardiomiopatia hipertrófica,81 doença infiltrativa ou restritiva ou isquemia aguda. 21 Além disso, a contração atrial contra uma valva AV fechada produz ondas A colidentes, que se opõem ao retorno venoso. Na verdade, Brockman e colaboradores demonstraram uma inversão do fluxo sangüíneo da veia cava superior, durante a estimulação ventricular.17 Alicandri e associados propuseram um reflexo barorreceptor atrial em três pacientes com hipotensão e síncope após a instituição da estimulação ventricular.2 Esse reflexo resultava em vasodilatação inadequada, em resposta à contração atrial contra valvas AV fechadas. Em seu estudo, Erlebacher chegou a resultados comparáveis.40
Como já foi discutido, muitos receptores de marcapassos ventriculares de câmara única, principalmente os portadores da síndrome do nódulo sinusal doente, demonstram condução ventrículo-atrial retrógrada durante a estimulação com marcapasso ventricular. A condução ventriculoatrial pode ocorrer pela via de condução normal, ou por um trato acessório, pode ser intermitente ou persistente apesar do bloqueio AV anterógrado, e é facilitada pela estimulação AV.1 Embora a condução ventriculoatrial varie acentuadamente em tempo, pode haver efeitos hemodinâmicos acentuados, resultantes da arritmicidade da contração atrial, dos quais os mais importantes são as reduções significativas na pressão arterial e débito cardíaco.107 Todos os efeitos deletérios da atividade AV descoordenada, durante a estimulação ventricular, citados acima, têm sido descritos clinicamente e o conjunto dos seguintes sintomas tem sido denominado síndrome do marcapasso: fadiga, vertigem, sensação de plenitude na garganta e hipotensão relativa que acompanha a estimulação ventricular.61,98 Os pacientes com essa síndrome, ou estado crônico de baixo débito, geralmente melhoram com o uso de marcapasso de câmaras duplas, que coordenam os eventos AV, possibilitam o sincronismo AV e, quando há um mecanismo sinusal intacto e adequadamente sensível, permitem variações de freqüência em resposta ao estresse fisiológico.
Nós utilizamos essas unidades "fisiológicas" em cerca de 60% dos pacientes encaminhados para receber marcapasso em nossa instituição e recomendamos esses dispositivos para pacientes com comprometimento da função ventricular, ou sinais de condução ventriculoatrial durante a estimulação ventricular. Nossos critérios excluem os indivíduos com fibrilação atrial ou ritmo atrial instável, os que raramente precisariam de estimulação, os portadores de átrios inativos "gigantes" e os pacientes com doenças incapacitantes concomitantes. Estes pacientes têm menor chance de se beneficiarem com as unidades fisiológicas, embora possam ser candidatos aos dispositivos de câmara única baseados em sensor.
O objetivo da estimulação com marcapasso cardíaco, portanto, evoluiu da estabilização da freqüência cardíaca para a melhoria de rendimento do coração. A estimulação cardíaca com unidades fisiológicas oferece vantagens significativas em relação à estimulação ventricular isolada. As unidades fisiológicas modernas, contudo, não variam o intervalo P-R com a elevação da freqüência, como ocorre com o coração normal, e o padrão de contração ventricular não é tão ordenado quanto durante a propagação normal do impulso ao longo do sistema de condução.85 Estudos Doppler e hemodinâmicos em repouso têm revelado melhoras significativas no débito cardíaco e reduções na pressão capilar pulmonar.31,86,146 Estudos sobre exercício agudo e crônico têm evidenciado melhora da tolerância ao esforço, maior captação de oxigênio e maior débito cardíaco durante o esforço máximo, resultando em melhorias dos parâmetros sintomatológicos.86 Também têm sido relatados menos episódios embólicos e crises menos freqüentes de fibrilação atrial com as unidades DVI de câmaras duplas, do que com as VVI.148 Finalmente, tem sido sugerido que a estimulação atrial regular crônica exerça uma influência estabilizadora e retarde o desenvolvimento de ritmos ectópicos.148
Métodos de Implantação dos Marcapassos
Marcapassos Temporários
O método preferível depende da experiência do médico. A exposição direta de uma veia adequada, através da dissecção cirúrgica de veia jugular externa ou do antebraço, tem sido menos usada desde que as técnicas de punção da veia subclávia, jugular interna ou femoral passaram a ser usadas mais amplamente. Embora muitos médicos ainda prefiram a visualização direta, as desvantagens do posicionamento menos estável do eletrodo, flebite, necessidade de ligadura da veia receptora e imobilidade imposta, que caracterizam as inserções de eletrodos venosos, têm desestimulado a utilização de técnicas alternativas.
Introdução do Eletrodo
VEIA SUBCLÁVIA. A utilização de veia subclávia para marcapassos temporários (assim como para cateteres venosos centrais) é preferível por vários motivos. A abordagem infraclavicular parece ser, psicologicamente, menos ameaçadora para os pacientes do que a abordagem pelo pescoço ou virilha, provoca menos desconforto e o eletrodo tem menor chance de deslocar-se ou contaminar-se. As marcas anatômicas usadas para a punção percutânea da veia subclávia são mais invariáveis do que as utilizadas em outros locais e menos sujeitas à distorção pela obesidade. A lesão das estruturas adjacentes é geralmente pequena, contanto que se observe uma regra básica: se a veia não for encontrada em sua localização esperada nas primeiras poucas tentativas de puncioná-la, deve-se utilizar um outro local para introdução do eletrodo, ou deve-se solicitar a colaboração de outro colega. A maioria das complicações ocorre nos 5 a 10% dos pacientes nos quais a veia localiza-se em posição anômala em relação às marcas habituais. As tentativas repetidas de cateterizar a veia culminam, freqüentemente, em pneumotórax ou punção da artéria subclávia.
Após a preparação da pele com solução alcoólica ou iodada, é efetuada uma pápula cutânea com lidocaína a 0,5% no local escolhido para a punção, geralmente 1 cm abaixo de clavícula, na junção dos terços médio e interior. O ponto exato escolhido deve produzir uma linha horizontal ligando a junção da clavícula e o manúbrio (Fig. 9-23). É ao longo desse trajeto, justamente sob o terço interior da clavícula, que a veia subclávia mais comumente se encontra, atravessando a primeira costela no local em que ela se separa da artéria pela inserção do músculo escaleno anterior.
Após realizar um corte de 3 a 4 mm na pele com lâmina de bisturi nº 11, a agulha e o cateter introdutor, acoplados firmemente a uma seringa de 1 mI, são introduzidos através da pele seguindo o trajeto descrito acima. A agulha introdutora deve ser direcionada para o alto da articulação esternoclavicular, quase paralelamente ao plano frontal do corpo, porém formando um ângulo suficiente para passar sob a clavícula. Muitas vezes, isso é facilitado pela utilização do dedo indicador da mão livre para palpar e marcar a articulação esternoclavicular e pelo uso do polegar da mesma mão para exercer pressão ligeiramente lateral ao local da punção, dessa forma empurrando a agulha sob a clavícula, em direção praticamente paralela à pleura. Um trajeto muito próximo à clavícula é indesejável, devido à probabilidade de punção dolorosa do periósteo, com torção do cateter introdutor e resistência resultante em sua manipulação. Exercendo pressão negativa constante com a seringa, a penetração da veia é assinalada pela aspiração livre de sangue. Em geral, isso ocorre quando a ponta da agulha tiver percorrido quase a metade ou dois terços da distância do ponto de punção até a articulação esternoclavicular e corresponde ao ponto em que a veia subclávia passa entre a clavícula e a primeira costela. Se as tentativas de puncionar a veia forem infrutíferas, a agulha deve ser sempre retirada quase até a pele, antes que sua direção seja alterada, a fim de evitar a laceração das estruturas subcutâneas.
Quando o sangue confirma que a ponta da agulha está na veia, essa deve avançar por mais 2 a 3 mm enquanto o fluxo sangüíneo está se fazendo livremente, a fim de garantir que o cateter introdutor esteja no interior da veia quando ele for avançado sobre a ponta da agulha. Enquanto o paciente prende a inspiração, a agulha é retirada e o eletrodo do marcapasso temporário pode ser introduzido através do cateter introdutor. Alternativamente, pode-se introduzir um fio-guia com ponta em "J", caso se deseje a substituição, através da técnica de Seldinger, por um cateter mais calibroso de introdução. A utilização de um introdutor com saída lateral para soluções intravenosas e uma válvula diafragmática para o eletrodo do marcapasso atende aos dois objetivos, com uma única via de acesso na circulação venosa central.
VEIA JUGULAR INTERNA. A preparação da pele e a recomendação geral contra a insistência inadequada são as mesmas que para a técnica da veia subclávia. A veia jugular interna encontra-se ao lado e em posição ligeiramente anterior à artéria carótida comum, sob a porção inferior do músculo esternocleidomastóideo (ECM). Em condições ideais, é aconselhável palpar a artéria carótida ao nível do local desejado para a punção. Infelizmente, isso freqüentemente não é possível na parte inferior do pescoço; por esse motivo, têm sido propostas muitas técnicas utilizando marcações superficiais. Nosso método preferido é o que parece ser melhor, quanto à orientação do trajeto da agulha fugindo da artéria carótida. Com a cabeça do paciente virada ligeiramente para o lado oposto ao que será usado, a penetração superficial é efetuada no ápice, ou ligeiramente acima dele, do triângulo criado pelos dois braços do músculo ECM e a clavícula (Fig. 9-24). Ouando as marcações superficiais forem difíceis de ver ou palpar, o ponto de penetração deve estar a aproximadamente três dedos de largura acima da clavícula (ou 2 a 3 cm lateralmente à linha média, ao nível do entalhe da cartilagem tireóidea superior). É sempre aconselhável fazer uma tentativa de palpar a posição da artéria carótida nessa área e puxá-la medialmente com os dedos da mão livre. Depois, a agulha é orientada distalmente, num ângulo de 30 graus em relação ao plano frontal e ligeiramente para fora da linha média. Em geral, a veia está no interior do triângulo descrito acima, em direção à face medial do componente clavicular do músculo esternocleidomastóideo e, muitas vezes, ela está localizada muito superficialmente. Como "agulha exploradora" para a punção venosa inicial, pode-se usar uma agulha calibre 22 de 37 mm e uma seringa. Com o trajeto correto para a veia registrado visualmente, essa agulha é retirada e substituída pela agulha mais calibrosa e cateter introdutor, usando a mesma técnica de aspiração descrita para a punção subclávia.
VEIA FEMORAL. O acesso femoral pode ser satisfatório para a utilização a curto prazo, porém para períodos mais prolongados seus inconvenientes incluem esterilidade deficiente, instabilidade da posição do eletrodo e predisposição à tromboflebite. Além disso, a obtenção de um posicionamento intracardíaco satisfatório através da abordagem às cegas é freqüentemente difícil a partir da veia femoral, em virtude da tendência do eletrodo passar para as veias renais, esplênicas ou hepáticas durante seu trajeto. Devido à profundidade da veia femoral e ao fato de que é preciso penetrá-la em um ângulo mais reto do que as outras veias calibrosas, nós preferimos inserir o cateter introdutor sobre um fio-guia, em vez de diretamente sobre a agulha. Portanto, a agulha de Potts e a técnica de Seldinger convencional são usadas para introduzir o cateter introdutor mais profundamente do que normalmente conseguido com os eletrodos de marcapassos temporários. A artéria femoral é palpável 1 a 2 cm abaixo da dobra da virilha e supõe-se que a veia esteja cerca de 1 em para dentro do pulso arterial (Fig. 9-25). Utilizando a pápula cutânea anestésica mencionada acima e a incisão com lâmina de bisturi, ao mesmo tempo em que se palpa o pulso, a agulha introdutora é passada diretamente para baixo e em direção ligeiramente cefálica, até que se obtenha fluxo sangüíneo venoso. A agulha pode ser avançada atravessando a parede da veia e, depois, aspirada lentamente à medida que é retirada. Deve-se tomar cuidado para que o local pretendido para a punção venosa esteja abaixo do ligamento inguinal, a fim de que uma punção arterial acidental possa ser mais facilmente comprimida.
Posicionamento do Eletrodo
Serão discutidos a seguir, a técnica geral para posicionamento do eletrodo, os objetivos para as características de limiar e sensibilidade e os problemas que podem ocorrer no sistema.
TÉCNICA ÀS CEGAS. É sempre preferível usar a radioscopia para o posicionamento do eletrodo. Entretanto, uma parada cardíaca repentina ou bradicardia gravemente sintomática pode exigir a introdução do marcapasso "às cegas", à beira do leito do paciente. A introdução do marcapasso às cegas pode ser tentada pelas vias transvenosas, porém nos casos de assistolia, deve-se considerar a escolha de uma abordagem transtorácica. Qualquer que seja a via, o eletrodo pode ser conectado a um marcapasso temporário em estimulação plena e o eletrodo avançado até que haja sinais eletrocardiográficos de captura ventricular.
Antes da introdução transvenosa, deve-se fazer uma estimativa, externamente, do comprimento aproximado que o eletrodo deverá ter para chegar ao ápice do ventrículo direito. Se o eletrodo for calibrado, a distância dos pontos de introdução na veia jugular interna ou subclávia até o ápice do ventrículo direito geralmente é de 30 a 35 cm. A impossibilidade de se conseguir a captura com esse comprimento de eletrodo geralmente significa que ele está enrolado no átrio direito, ou passou e desceu para a veia cava inferior. A introdução e a retirada repetidas por mais 10 cm de eletrodo, ao mesmo tempo em que se aplica um movimento ligeiro de torção, podem conseguir ultrapassar o eletrodo pela valva tricúspide.
O acesso transtorácico deve ser usado quando as tentativas transvenosas falharem e a necessidade de estimulação cardíaca for maior do que o risco de laceração do pulmão ou artérias coronárias, tamponamento pericárdico ou hemorragia intramiocárdica. A agulha introdutora é passada pelo ápice cardíaco em direção ao ombro direito, no caso da punção do ventrículo esquerdo, ou da área subxifóide em direção ao ombro esquerdo, no caso da punção ventricular direita. Quando o sangue puder ser aspirado livremente, a ponta angulada do fio transtorácico deve ser introduzida tanto quanto possível, a agulha retirada sobre ele e o fio lentamente retirado ao mesmo tempo em que se estimula o marcapasso plenamente, até que se evidencie a captura.
Um método alternativo para orientação do eletrodo envolve o registro direto do eletrograma intracardíaco, através da conexão de um terminal do eletrodo marcapasso à derivação torácica de um eletrocardiógrafo bem aterrado (Fig. 9-26).13 A familiarização com o registro intracavitário esperado nas várias posições intracardíacas facilita a entrada no interior do ventrículo direito.
TÉCNICA RADIOSCÓPICA. Quando for usada a visualização direta sob radioscopia, a curva pré-fabricada nos últimos 5 ou 6 cm do eletrodo temporário deve ser usada para direcionar a ponta no sentido do ápice da silhueta cardíaca. Em geral, essa curvatura faz com que o eletrodo atravesse facilmente a valva tricúspide, a partir do acesso pela veia cava superior ou inferior. O eletrodo deve ser gentilmente avançado no sentido do ápice, reconhecendo-se que a cavidade ventricular direita habitualmente não se estende por toda a largura da silhueta cardíaca. Os melhores indicadores do posicionamento satisfatório são limiar reduzido para estimulação, estabilidade da estimulação durante a tosse ou respiração profunda e função sensorial adequada.
Marcapassos Permanentes
A introdução de um dispositivo implantável autocontido foi, originalmente, realizada através de uma incisão de toracotomia com sutura direta dos eletrodos à superfície epicárdica do coração. A mortalidade e morbidez operatórias inaceitáveis levaram à utilização de um método alternativo, que combina a facilidade da introdução transvenosa do eletrodo sob anestesia local com um gerador de pulsos implantável conectado. A não ser nos raros pacientes com valva tricúspide artificial, que impede a passagem do eletrodo transvenoso, a estimulação endocárdica transvenosa tem substituído, inteiramente, a estimulação transtorácica no Massachusetts General Hospital durante os últimos 20 anos.67
Todos os procedimentos para colocação de marcapassos permanentes são efetuados em laboratório montado com esse objetivo. Os procedimentos são realizados unicamente por clínicos, que se subespecializaram em cardiologia e cateterização, sob supervisão do autor superior. Um técnico de laboratório com experiência atual em laboratório de cateterismo cardíaco atarefado completa a equipe. É aconselhável que o técnico do laboratório de marcapasso mude de um procedimento para outro, já que a exposição constante a ampla variedade de sistemas de marcapassos diferentes e aos diversos tipos de implantes é necessária para estabelecer a confiança e familiarização com as diferenças mecânicas e eletrônicas sutis, porem importantes, entre os vários sistemas comercializados.
O procedimento geral é semelhante, seja para a implantação de marcapassos permanentes ventriculares, atriais ou de câmaras duplas. A maioria dos pacientes já tornou conhecimento da necessidade do procedimento por meio de seu próprio médico, antes de receber a visita de um membro da equipe na noite anterior ao procedimento. Nesta ocasião, deve-se discutir completamente o procedimento, sua duração, riscos, complicações pós-operatórias, permanência hospitalar habitual e sistema de acompanhamento. A anestesia geral tem sido raramente utilizada. Os pacientes não tomam qualquer medicamento além dos necessários por via oral, 8 horas antes do procedimento. A pré-medicação é administrada apenas para pacientes apreensivos. Habitualmente, o paciente já tem um marcapasso temporário, ou este, pode ser colocado de acordo com considerações individuais, porém ele não é considerado essencial em todos os casos.
O médico que realiza a implantação segue uma técnica de assepsia convencional prescrita pelo hospital, utilizando escovas impregnadas em Betadine. Toda a equipe deve usar máscara e gorro sobre aventais de chumbo com 0,50 mm de espessura. O local para a introdução do marcapasso é escolhido tendo-se vários aspectos em mente. Quando possível, devem ser levadas em consideração a habilidade predominante do paciente com a mão direita ou esquerda, seus passatempos ou ocupações que exijam o uso predominante de um braço, em detrimento do outro. A parte superior do tórax, incluindo-se a área jugular do pescoço no lado que foi escolhido, deve ser cuidadosamente preparada com sabão cirúrgico, solução preparatória cirúrgica (contendo álcool a 70%) e éter. Compressas estéreis são aplicadas para demarcar a área escolhida. E preciso tomar cuidado para não tocar a área esterilizada da pele, até que tenha sido aplicado um esparadrapo plástico adesivo esterilizado (Steridrape, Minnesota Mining and Manufacturing). Após a infiltração com lidocaína a 0,5%, faz-se uma incisão curvilínea no sulco deltopeitoral; o ramo cefálico do sistema axilar é identificado no sulco entre o bordo medial do músculo deltóide e o peitoral. Cerca de 85% dos pacientes têm uma veia cefálica adequada para uso. Alternativamente, pode-se realizar a punção da veia subclávia e o(s) eletrodo(s) introduzido(s) através de um cateter percutâneo. Se houver sido efetuada a dissecção direta, faz-se uma pequena venotomia após a ligadura distal da veia e são introduzidas pinças de pontas lisas para abrir suas margens. O eletrodo a ser usado é introduzido e, em geral, passa facilmente até o átrio. Ocasionalmente, são encontradas dificuldades devidas à tortuosidade ou mesmo trombose dos vasos. Em geral, estas podem ser superadas pela retirada ligeira do estilete do eletrodo, possibilitando à ponta prolapsada ou "torcida" ultrapassar a obstrução. Muitas vezes, uma curvatura moderadamente aguda no estilete, a inspiração profunda do paciente e a conversa calma do médico ajudam o processo. Quando vias venosas alternativas não estiverem disponíveis, pode-se tentar a trombectomia de um sistema venoso subclávio-axilar coagulado, ou a dilatação de um segmento estenosado de uma veia, através da introdução progressiva de cateteres com pontas cada vez mais grossas sobre uma guia de arame, combinada à utilização do cateter com balão tipo Fogarty.
Depois de se chegar ao átrio direito, o radioscópio (recoberto com campos estéreis) é posicionado sobre o paciente. (Sempre que a incisão não exigir o acesso direto, ela é mantida coberta com uma compressa estéril.) A passagem do eletrodo do átrio para o ventrículo direito é facilitada pela utilização de estiletes de curva turas variáveis, produzidas enrolando-se o eletrodo sobre o dedo do operador. Depois que o ventrículo tiver sido atingido, o posicionamento final geralmente é mais facilmente conseguido com um estilete reto, ou um com ligeira curvatura. O estilete deve ser ligeiramente retirado, a fim de que a ponta permaneça flexível durante o posicionamento. A delicadeza no manuseio do eletrodo é fundamental. É preciso "espetar" a ponta flangeada no interior das trabeculações do ventrículo direito, em vez de simplesmente empurrá-lo para o interior do ápice, na esperança de que ele "penetre". Podem ser necessárias várias tentativas em posições diferentes, antes que o operador tenha certeza da posição estável, cuja confirmação pode ser facilitada pela observação do posicionamento do eletrodo durante a retirada ligeira. (O estilete deve ser removido.) Quando o eletrodo estiver corretamente posicionado, ele pode ser "solto" do assoalho do átrio sem movimentar a ponta. Ocasionalmente, pode-se notar uma sensação leve de puxão pelo coração.
A determinação adequada do limiar de estimulação precisa ser efetuada na amplitude de pulso do gerador a ser usado. Os limiares aceitáveis variam de acordo com a área e formato do eletrodo usado, porém geralmente estão abaixo de 1,0 ma e, muitas vezes, abaixo de 0,5 ma. Nosso procedimento inclui a estimulação plena para testar o aparelho e detectar a contração diafragmática, que pode ser incômoda para o paciente mais tarde. O eletrodo é reposicionado, até que esteja em uma posição que tenha estabilidade física, limiar aceitável e ausência de contração diafragmática na faixa de estimulação do aparelho a ser usado. A potência do sinal endocárdico também tem importância essencial, na certificação do funcionamento da demanda adequada e pode ser determinada com a maioria dos dispositivos de teste existentes no comércio.
Depois que se encontra uma posição aceitável, o eletrodo é fixado em seu ponto de penetração na veia, utilizando-se luva de ancoragem revestida, a fim de evitar o deslocamento. Um comprimento suficiente de eletrodo é deixado no interior do coração, a fim de permitir uma curvatura suave através da valva tricúspide. (Quantidades excessivas de eletrodo produzem ressalto, encurvamento ou alças reais e facilitam o deslocamento e a formação de coágulo.)
O eletrodo atrial, caso seja introduzido, tem geralmente o formato em "J" pré-estabelecido. A maioria dos eletrodos utilizada atualmente no Massachusetts General Hospital é revestida de poliuretano (tanto atriais quanto ventriculares). Isso possibilita diâmetros menores e menor coeficiente de atrito, que muitas vezes permite a introdução dos dois eletrodos através do mesmo cateter ou veia. Um estilete reto retifica o eletrodo atrial em "J", a fim de possibilitar sua passagem para o átrio direito. Depois da retirada do estilete, o formato em anzol é readquirido. A anatomia habitual do átrio direito geralmente faz com que a ponta do ''J'' caia anteriormente no interior do apêndice. Quando estiver posicionado adequadamente, o eletrodo "balança" para frente e para trás, semelhante ao rabo de um cachorro. Em geral, os limiares são iguais ou ligeiramente maiores que os limiares do ventrículo. A amplitude das ondas P atriais varia amplamente, porém em média tem 2 a 3 mV. O eletrodo atrial é fixado de forma semelhante ao ventricular, deixando-se sobra suficiente para a excursão respiratória (Fig. 9-27).
Uma bolsa ("três dedos de largura, três dedos de comprimento") é formada sob o tecido subcutâneo, porém à frente da fáscia peitoral e o marcapasso e seu eletrodo conectado são introduzidos. É preciso ter atenção máxima para a hemostasia, antes de fechar com suturas cutâneas de náilon 510 e Dexon 3/0 subcuticular, ou Steristrips. Depois, aplica-se pomada de Betadine e um pequeno curativo, que não deve ser trocado antes de cinco a sete dias. Nós não usamos dreno subcutâneo e não lavamos a bolsa com antibióticos. Todos os pacientes permanecem no leito sob monitorização cardíaca por 24 horas e, depois, podem andar livremente. O eletrodo temporário, se estiver presente, é sempre retirado sob orientação radioscópica, a fim de evitar deslocamento do sistema permanente. A cobertura antibiótica é administrada apenas para as inserções de marcapasso primário e consiste em uma penicilina semi-sintética (cloxacilina, dicloxacilina) na dose oral de 2 g diariamente, durante cinco a sete dias depois do procedimento.
Acompanhamento do Marcapasso
O acompanhamento de um paciente com marcapasso cardíaco começa no momento de sua introdução e continua, no caso da unidade temporária, até que seja retirado ou que o paciente morra. O médico responsável pelo acompanhamento precisa estar familiarizado com a tecnologia dos marcapassos, métodos de implantação e vários mecanismos de falência dos dispositivos, além de possuir a mentalidade de Agatha Christie.
Marcapasso Temporário
A maioria dos marcapassos temporários utiliza os denominados eletrodos de estimulação transvenosa semiflutuantes, que são introduzidos por punção venosa e posicionados pelo controle eletrocardiográfico ou radioscópico. Complicações na introdução dependem da abordagem usada e incluem punção arterial acidental, pneumotórax e bacteriemia. A impactação da ponta do eletrodo no interior das trabeculações do ventrículo direito é menos segura do que no caso dos eletrodos permanentes, e a migração da ponta do eletrodo para outra posição, diferente daquela escolhida originalmente, é comum. Ocasionalmente, a ponta do eletrodo frouxa produz a captura caótica ou batimentos ectópicos ventriculares (Fig. 9-28). Nos casos em que o eletrodo voltar para o átrio, pode haver estimulação atrial. Mais comumente, a captura ventricular errática, a sensibilidade variável ou ambas refletem a penetração da ponta do eletrodo através da parede ventricular direita até o espaço pericárdico. Isso pode ser indicado por uma síndrome de dor torácica precordial transitória, atrito pericárdico e estimulação diafragmática ou da parede torácica.62 A equipe de enfermagem, acostumada ao registro das freqüências do pulso apical, pode ser iludida, caso os pulsos radiais simultâneos não sejam aferidos. A troca diária do curativo, com aplicação de Betadine ou outro antibiótico tópico, reduz a ocorrência de sépsis no local da introdução do eletrodo. O exame cuidadoso e freqüente das conexões do eletrodo e pontos de contato com o Marcapasso externo deve ser uma prática rotineira, a fim de detectar o isolamento por desgaste ou desligamento. Os terminais desprotegidos do eletrodo devem ser cuidadosamente evitados, em virtude do escape de corrente para o coração, produzindo fibrilação ventricular, se o equipamento elétrico auxiliar não estiver adequadamente aterrado.144
Os Marcapassos temporários são equipados com controles de freqüência, ativação e sensibilidade. A função dos dois primeiros falam por si mesmas, porém um comentário acerca da função do regulador de sensibilidade pode ser útil. O objetivo desse controle é possibilitar uma sensibilidade variável do dispositivo, que se modifica de nenhuma (estimulação com freqüência fixa assincrônica), até aproximadamente 1,5 a 2,0 mV. O conhecimento de que o amplificador de sensibilidade irá "ignorar" sinais abaixo da sensibilidade ajustada pelo regulador é fundamental para compreender o funcionamento correto do dispositivo. A capacidade de se ajustar a sensibilidade é proporcionada a fim de que o médico possa atenuar a possível detecção pelo Marcapasso de sinais de baixa amplitude, como ondas P ou T. A amplitude do potencial intracardíaco registrado pelo eletrodo é determinada por vários fatores, incluindo-se a viabilidade do tecido miocárdico na superfície de contato entre eletrodo e miocárdio, distância entre o anodo e catodo do eletrodo ("dipolo"), freqüência cardíaca, níveis de catecolamina circulantes, posição do corpo, nível de atividade e, indubitavelmente, vários outros fatores desconhecidos. Os eletrodos que terminam em uma área de miocárdio cicatrizado, ou gordura epicárdica, ou que estão posicionados muito próximos entre si (como ocorre freqüentemente com os eletrodos epicárdicos pós-operatórios, em pacientes de cirurgia cardíaca), podem produzir um eletrograma com amplitude insuficiente para ativar o amplificador sensorial do marcapasso temporário. Isso pode ser corrigido pelo reposicionamento do eletrodo transvenoso, até que se obtenha um sinal adequado, ou por sua transformação em unipolar, dessa forma amplificando o dipolo do sinal registrado. Este último procedimento é efetuado introduzindo-se um eletrodo cutâneo neutro em algum local distante do coração. De preferência, isso deve ser feito sobre uma área óssea, como a clavícula, a fim de evitar contração muscular subjacente. Depois, a estimulação é efetuada ligando-se o eletrodo neutro ao terminal positivo do Marcapasso e qualquer uma das derivações cardíacas ao terminal negativo. A potencialização resultante do sinal registrado é, em geral, suficiente para corrigir a deficiência de sensibilidade.
Antibióticos, anticoagulação profilática e repouso forçado no leito são desnecessários, a menos que indicados pelos outros aspectos da assistência ao paciente. Os Marcapassos de demanda temporários são, em geral, mais suscetíveis à interferência elétrica estranha, de forma que se pode observar a supressão transitória da ativação, em resposta às emissões de radiofreqüências originadas de eletrocautérios, barbeadores elétricos ou outro equipamento operado eletricamente (Fig. 9-29).
Marcapasso Permanente
Apesar dos progressos notáveis obtidos na tecnologia dos marcapassos durante os últimos 20 anos, ainda não existe um sistema de marcapasso implantável, que realmente possa ser considerado "permanente", no sentido de não ser suscetível à falência potencial, depois da instalação inicial. Os possíveis problemas que podem ocorrer são divididos em agudos (dentro de 2 semanas), subagudos (2 semanas a 3 meses) ou crônicos (depois de 3 meses).
Problemas Agudos
A grande maioria das complicações que se seguem à implantação inicial está relacionada às complicações cirúrgicas no local da introdução, ou ao posicionamento indevido do eletrodo. A maior parte dos problemas relacionados à incisão ou bolsa é evitável com a atenção meticulosa para as técnicas anti-sépticas e hemostasia. A infecção no local do marcapasso ocorre em menos de 1% dos pacientes que recebem esses dispositivos; quando isso ocorre, em geral ela é devida à deiscência secundária do ferimento, resultante de um hematoma da bolsa, reexploração repetida para correção da posição incorreta do eletrodo ou erosão mecânica de algum componente do sistema marcapasso. Raramente, a infecção do marcapasso pode ser tratada pelo desbridamento local, combinado a antibióticos locais e sistêmicos, porém a remoção e substituição completas do sistema em outro local geralmente são necessárias. 28,51 Morgan e colaboradores acreditam que a substituição do sistema de marcapasso, mesmo que seja necessário realizar toracotomia para retirar o eletrodo, não deva ser adiada, enquanto o médico espera pelo sucesso do tratamento antibiótico, já que a probabilidade de morte do paciente pode ser grande se o tratamento antibiótico falhar e a sépsis recorrer. 100 A formação de hematoma em torno de gerador do marcapasso é mais comum na população de pacientes idosos. A administração de heparina, derivados coumarínicos ou agentes antiplaquetários pode acarretar sangramento significativo, depois do fechamento da bolsa. Isso pode ocorrer apesar do aparente controle hemostático e da reversão dos parâmetros anormais da coagulação e parece estar relacionado ao efeito abrasivo do sistema de marcapasso, combinado às anormalidades sutis residuais da coagulação, indetectáveis pelos exames laboratoriais rotineiros. Os hematomas que têm probabilidade de causar problemas mecânicos tendem a ser muito dolorosos, ao contrário daqueles que regridem rapidamente para os tecidos adjacentes e que raramente precisam de drenagem. A aspiração com agulha geralmente é ineficaz, já que a maior parte do sangue está coagulada. A introdução de bactérias pela agulha de aspiração é uma complicação em potencial. A reexploração cirúrgica e a retirada do coágulo devem ser consideradas nos pacientes em que, aparentemente, há tensão excessiva sobre a incisão.
Outra complicação aguda importante da inserção do marcapasso é o posicionamento incorreto da ponta estimuladora do eletrodo. Esse problema não está limitado aos eletrodos endocárdicos transvenosos e pode ocorrer quando os eletrodos de ponta espiral epicárdicos perderem sua inserção, após a fixação inicial inadequada. (A inexistência de movimentos dos eletrodos epicárdicos durante a contração cardíaca, observável pela radioscopia, sugere o deslocamento.) Em geral, o deslocamento dos eletrodos transvenosos resulta do posicionamento incorreto da ponta do eletrodo no momento da inserção inicial, de forma que a ponta não fique fixada no ventrículo direito (Fig. 9-30), ou seja, deslocada para o átrio direito. Essa última situação pode produzir estimulação atrial intermitente e contração hemidiafragmática direita, através da estimulação do nervo frênico ipsilateral. Em ambos os casos, é necessário reposicionar o eletrodo. A freqüência do deslocamento do eletrodo diminui com o aumento da experiência do operador, variando de menos de 1 a 59%, nos diferentes laboratórios.16,110 A utilização de eletrodos de fixação ativa nos pacientes sob grande risco, como nos portadores de regurgitação tricúspide, é freqüentemente adequada.
A outra causa de posicionamento incorreto do eletrodo é a penetração real da ponta através da parede ventricular direita, chegando à gordura epicárdica ou espaço pericárdico livre. Neste último caso, é comum. haver atrito pericárdico, assim como a síndrome mencionada antes de dor precordial transitória e intermitência da estimulação, muitas vezes associadas à preservação da sensibilidade. As radiografias de tórax podem ser inúteis, ou demonstrar o deslocamento lateral da ponta do eletrodo. O registro contínuo do eletrograma obtido durante a retirada confirma, muitas vezes, uma corrente de lesão à medida que o eletrodo atravessa o miocárdio (Fig. 9-31). Em alguns pacientes, o reposicionamento repetido do eletrodo pode ser necessário antes que se consiga a estabilidade.
O limiar de estimulação dos eletrodos recém-implantados aumenta três a cinco vezes durante as duas semanas subseqüentes à inserção, diminuindo a partir daí para cerca de duas vezes o limiar inicial. Em algum momento, o potencial do sinal endocárdico diminui, porém, finalmente, retorna para cerca de 80% do valor imediato.153 Portanto, em certas circunstâncias, as anormalidades transitórias de captura ou sensibilidade podem regredir apenas com o tempo.
Problemas Subagudos
Perfurações ou deslocamentos tardios dos eletrodos ocorrem raramente. A fim de detectar esses problemas, é aconselhável realizar uma telemetria telefônica semanalmente, durante 6 semanas. Um problema que ocorre freqüentemente durante esse intervalo, de ordem educacional ou psicológica, é que muitos receptores de marcapasso acham difícil se adaptar ao dispositivo recém-implantado. Os temores do paciente podem ser estimulados pelos membros da família bem intencionados, que descrevem as lembranças de marcapassos prévios, ou a supressão do dispositivo por sinais ambientais estranhos. Comumente, os pacientes expressam preocupações sobre a mobilidade e migração do marcapasso ("Ele sairá ?"), reforçando a necessidade de educação dos pacientes na época da internação e a importância da tranqüilização contínua.
Os sintomas da "síndrome do marcapasso" podem só ser evidenciáveis várias semanas após a inserção inicial, à medida que o paciente reassume uma vida mais ativa.30,61,117 Episódios de fraqueza e vertigem coincidentes com o início da estimulação sugerem a existência dessa síndrome. O registro da pressão arterial pode revelar uma queda de 50 a 75 mmHg quando o transporte atrial for interrompido com a introdução da estimulação ventricular (Fig. 9-32).117 O fenômeno ocorre mais comumente em pacientes com a "síndrome do nódulo sinusal doente", que apresentam condução retrógrada (ventriculoatrial), durante a estimulação ventricular. Pode ser preciso converter para um mecanismo mais fisiológico de estimulação. A reprogramação da freqüência de escape do marcapasso para um nível inferior pode ser suficiente (Fig. 9-33).
Erosões Mecânicas
A erosão do marcapasso pela pele pode necessitar de substituição completa do sistema, caso haja infecção secundária. Os pacientes devem ser orientados a inspecionar a área sobre o gerador do marcapasso e registrar e relatar, periodicamente, sintomas de prurido, hiperestesia ou alteração na cor da pele. Esse problema tem sido mais comum com os dispositivos maiores, principalmente dispositivos com protuberâncias ou bordas agudas. A redução do tamanho e o formato mais fisiológico dos aparelhos modernos certamente não atenuaram esse problema. O uso de bolsa de Dacron*** em torno do gerador estimula uma reação de tecido fibroso intensa e reduz, comprovadamente, a incidência de erosão subseqüente. 109,111 Em pacientes com erosão do marcapasso, que não disponham de via alternativa para inserção do sistema, e caso haja um eletrodo extravascular estéril disponível, podese utilizar técnica de formação de túnel e costura (Fig. 9-34). Alguns pacientes com essa complicação podem ser exemplos da "síndrome do bulidor do marcapasso". A manipulação desnecessária do marcapasso deve ser desestimulada.7
Desgaste da Bateria
Todos os dispositivos de marcapasso (com exceção dos biogalvânicos) têm uma quantidade finita de energia a ser fornecida ao circuito eletrônico. A longevidade final do aparelho depende de muitos fatores, incluindo-se a fonte de energia, taxa de estimulação, freqüência da supressão (nas unidades de demanda), escapamento interno e falhas na construção da célula.
Existem diferenças importantes nas diversas fontes de energia, de forma que é impossível prever a longevidade esperada de um marcapasso nuclear ou de lítio, sem se conhecer grande parte das informações técnicas acerca do tipo de célula e consumo de corrente do circuito empregado. Teoricamente, pode-se estimar a vida projetada de um marcapasso, através da seguinte fórmula:
Vida projetada
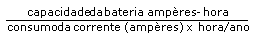
Na prática, as variáveis clínicas e fisiológicas que influenciam o rendimento do marcapasso atenuam a precisão dessas estimativas. A taxa de estimulação de quase todos os dispositivos está relacionada à voltagem liberada. Com o desgaste da bateria, a taxa de estimulação diminui e constitui um indicador razoavelmente preciso da falência iminente do marcapasso. Uma queda percentual de 10% da taxa ajustada de estimulação indica a necessidade de substituir o gerador (Fig. 9-35), Para os pacientes cuja atividade cardíaca está abaixo do controle contínuo pelo marcapasso, o registro simples da freqüência de pulso pela "radioausculta"**** constitui um método de auto monitorização da função do marcapasso.
Os dispositivos alimentados por lítio variam quanto aos sinais de desgaste da bateria. Alguns conservam a freqüência estável durante toda a vida útil do gerador, outros evidenciam uma redução gradativa, porém progressiva na freqüência até o final da vida, quando há uma falência rápida; outros ainda apresentam um platô de freqüência duplo, com pelo menos 1 ano de função residual eficaz projetada, quando a segunda freqüência for atingida. Cada dispositivo deve ser analisado individualmente, de acordo com as recomendações fornecidas pelo fabricante. A análise das ondas de pulso, através dos registros osciloscópicos e da determinação da extensão do pulso, pode fornecer informação adicional para a determinação simples da freqüência.
Fratura do Eletrodo
A conformação em espiral elástica helicoidal dos sistemas de eletrodos existentes e a evitação meticulosa das suturas restritivas em torno do eletrodo têm reduzido a incidência de fraturas, bem abaixo da incidência prévia de 2 a 3% ao ano. 112 A maioria das fraturas ocorre em pontos de fixação mecânica ou angulação. As fraturas dos eletrodos transvenosos geralmente se localizam no ponto de penetração no sistema venoso (Fig. 9-36), ou próximo ao gerador de pulsos. Os eletrodos transtorácicos podem quebrar no gerador, no miocárdio, devido ao estresse de cisalhamento, ou nos locais de flexão em que eles saem da cavidade torácica. Os sinais funcionais de fratura do eletrodo evidenciam-se como captura intermitente, muitas vezes relacionada às alterações na posição corpórea, respiração ou manipulação manual da área fraturada. A correção por emenda é facilmente efetuada, se a área quebrada for acessível. Deve-se assinalar que essa emenda serve como ponto de estresse potencial para fraturas futuras.
Disfunção dos Componentes
Caracteristicamente, as anormalidades do circuito eletrônico apresentam-se com rendimento caótico ou imprevisível do marcapasso (Fig. 9-37). Com os dispositivos mais antigos, algumas vezes ocorria fuga do marcapasso, com conseqüências potencialmente fatais.103 As falhas no circuito também podem acarretar a interrupção súbita ou intermitência da estimulação, ou desgaste prematuro das reservas de energia. Conseqüências semelhantes podem ocorrer após a formação de crescimentos dendríticos devido a impurezas no interior do compartimento do marcapasso, que têm sido observadas em alguns marcapassos recentes.84
Anormalidades Sensoriais
As anormalidades sensoriais podem ocorrer como subsensibilidade dos sinais cardíacos intrínsecos, ou hipersensibilidade dos sinais cardíacos, extracardíacos (porém intracorpóreos) ou ambientais exteriores. A subsensibilidade quase sempre é uma conseqüência do potencial limítrofe dos sinais dos complexos cardíacos intrínsecos e enfatiza a importância de se determinar esse parâmetro, na época em que forem efetuadas as determinações do limiar. Em alguns pacientes, provavelmente devido à fibrose miocárdica difusa, isso pode envolver todos os complexos QRS, de forma que o marcapasso funcione como unidade de freqüência fixa (Fig. 9-38); em outros, apenas complexos aleatórios não conseguem ser detectados. É preciso enfatizar que a amplitude, isoladamente, não e a única variável para a qual o amplificador sensorial é ajustado. A "qualidade" do sinal também pode ser importante.52 Um eletrograma endocárdico com taxa lenta de alteração da deflexão intrínseca ("taxa de inversão") pode não conseguir ativar o amplificador sensorial, apesar da amplitude aparentemente adequada dos sinais. A correção desse problema, que é raro, pode ser conseguida pela conversão da estimulação bipolar para unipolar (ou, ocasionalmente, vice-versa), porém geralmente requer o reposicionamento do eletrodo ou a utilização de um dispositivo com características de sensibilidade mais adequadas.
A hipersensibilidade de sinais indesejáveis é mais problemática e pode ser potencialmente fatal, se houver inibição prolongada da estimulação do marcapasso. Os sinais detectados podem ser intra ou extracardíacos (porém intracorpóreos), ou ainda extracorpóreos. Um exemplo de hipersensibilidade intracardíaca é a detecção das ondas T (ver Fig. 9-10). Na maioria dos sistemas de marcapasso implantáveis, um período refratário programável, assim como freqüência precisamente ajustada no amplificador sensorial, evitam esse problema, que é mais comum com os marcapassos externos. Quando forem usados marcapassos de demanda para a estimulação atrial, a detecção do complexo ORS (ver Fig. 9-11) é um fenômeno semelhante, embora não seja realmente indicativo de disfunção. O amplificador sensorial também pode detectar sinais extracardíacos, como a contração diafragmática durante a tosse ou soluços, ou as contrações miotónicas em torno de um gerador unipolar (ver Fig. 9-5).6
A imprensa leiga tem enfatizado o problema da supressão da estimulação do marcapasso, devido à captação de estímulos ambientais, como os sinais de radiofreqüência (ver Fig. 9-29), emissões de radar ou radiação de microondas.25.128,170 Embora o médico deva conhecer essa possibilidade, a confirmação de ocorrências sintomáticas é rara. A interferência eletrostática com a função do marcapasso de demanda unipolar, devida ao contato com instrumentos metálicos ou agulhas durante a cirurgia, ocorre ocasionalmente. A supressão transitória da ativação do marcapasso, resultante da aplicação intermitente de um ímã durante a comutação magnética, é um outro exemplo de "pseudodisfunção" (Fig. 9-39). A utilização intencional dessa inibição magnética pode ser efetuada para se determinar se o paciente tem um ritmo de escape subjacente.5
Obstrução Venosa
A obstrução venosa, resultante da trombose em torno do eletrodo implantado, ocorre com mais freqüência do que geralmente se avalia pelas manifestações clínicas. Certo grau de estenose venosa ou trombose ipsilateral, que raramente pode progredir para obstrução da veia cava superior,149 ocorre em 80% ou mais dos pacientes (Fig. 9-40). No caso ilustrado, o paciente apresentou-se com sinais de hidrocefalia, que finalmente regrediram depois que houve a recanalização.
Acompanhamento do Marcapasso DDD
Embora os princípios sejam semelhantes à análise dos sistemas de câmaras únicas convencionais, o acompanhamento dos dispositivos de câmaras duplas pode parecer assustador para o médico inexperiente. É aconselhável enfatizar que esses dispositivos consistem em circuitos de ativação, ritmicidade e sensibilidade para as câmaras atriais e ventriculares, com um circuito lógico que inter-relaciona as atividades de um canal com o outro. Um marcapasso DDD funcionando normalmente (ver Fig. 9-17) apresentará sensibilização e/ou estimulação do átrio ou ventrículo em um intervalo entre dois batimentos consecutivos, dependendo dos lapsos momentâneos na geração ou condução do impulso original. Talvez a anormalidade ECG mais comum nesses aparelhos seja a ocorrência de insensibilidade atrial (Fig. 9-41), devido à amplitude subliminar das ondas P no eletrodo atrial. Se esse fenômeno se tornar freqüente, a unidade funcionará como um dispositivo DVI, apesar de sua estrutura DDD programada. O desenvolvimento de taquiarritmias atriais pode omitir o rastreamento da freqüência superior pelo dispositivo DDD, se o foco ectópico atingir amplitude suficiente para ativar o amplificador sensorial atrial (Fig. 9-42). Dois tipos diferentes de função sensorial são oferecidos pelo canal atrial (inibição da ativação pela atividade atrial espontânea, com desencadeamento da ativação ventricular por essa mesma onda P atrial captada). A detecção da contração miopeitoral na vizinhança dos marcapassos DDD unipolares pode produzir respostas inabituais (Fig. 9-43). Na maioria destes casos, a reprogramação das sensibilidades de cada canal, ou a escolha de um modo alternativo de estimulação, serve para corrigir o rendimento indesejável do marcapasso. O amplificador sensorial atrial pode captar ondas P conduzidas em direção retrógrada, após batimentos ectópicos ventriculares espontâneos ou estimulados, se essas ondas P caírem fora do período refratário atrial pós-ventricular programado. Essas ondas P captadas podem, então, suprimir um batimento ventricular estimulado anterógrado e, se o ciclo da condução retrógrada com sensibilidade atrial for mantido, pode haver uma taquicardia de reentrada ou "alça sem fim" (ver Figs. 9-19 e 9-44). A maioria dos dispositivos DDD atuais oferece um período refratário atrial programável, que possibilita ao médico tornar o canal atrial "cego" à ocorrência de ondas P retrógradas. O período refratário atrial total consiste na soma do retardo AV e do período refratário atrial pós-ventricular, e esta soma determina a taxa de rastreamento superior do dispositivo (ver Fig. 9-20). Portanto, embora seja possível estender o período refratário atrial pós-ventricular para bloquear a captação da condução ventrículo-atrial retrógrada, isso reduz a freqüência do rastreamento superior que o dispositivo pode atingir, a menos que o retardo AV programado seja diminuído proporcionalmente. As causas de taquicardia do marcapasso estão relacionadas no Quadro 9-3.
Um fenômeno observado infreqüentemente, mas que assinala um desafio de composição significativo dos dispositivos unipolares, é conhecido como "comunicação cruzada". Isso ocorre quando o estímulo de ativação atrial, que provoca a despolarização do átrio, for detectado pelo circuito sensorial ventricular, com inibição resultante da ativação ventricular (ver Fig. 9-15). Evidentemente, isso expõe o paciente dependente do marcapasso ao risco de entrar em assistolia. As medidas eletrônicas que têm sido incorporadas ao circuito para evitar essa ocorrência incluem as técnicas de "anulação" do amplificador sensorial ventricular no instante da estimulação atrial, mais um método conhecido como de "estimulação de segurança ventricular". Essas duas inovações podem produzir seus próprios ECG algo confusos (Fig. 9-45).
Indicações para os Marcapassos Cardíacos65
Existe pouca dúvida acerca da adequação da prescrição de marcapasso para pacientes que se apresentem com episódios de colapso, pré-síncope ou vertigem momentânea, comprovadamente relacionados às crises de bradicardia. Menos evidentes são os pacientes nos quais a relação entre a bradicardia suspeita e os episódios de sensibilidade deprimida não puder ser comprovada. Isso inclui pacientes com síncope de origem desconhecida, portadores da doença do nódulo sinusal com freqüências cardíacas variáveis, porém relação imprecisa com os sintomas, e pacientes cujo ritmo original foi alterado pela administração de medicamentos anti-hipertensivos e antiarrítmicos. Infelizmente, embora a remuneração profissional pela cirurgia do marcapasso tenha chegado de US$ 1.500 a 2.000, os médicos têm, ocasionalmente, sido levados à utilização mais liberal dessa tecnologia, do que seria justificado pela boa prática clínica.71 Uma comissão conjunta da American Heart Association (AHA) e American College of Cardiology (ACC) publicou orientações gerais, que são suficientemente liberais para cobrir a maioria das condições clínicas, ainda que enfatizem a classificação do paciente.49 O leitor é encaminhado à publicação original, caso deseje mais detalhes. Em resumo; os receptores de marcapassos em potencial são agrupados nas seguintes categorias:
Classe I: consenso geral favorece o uso do marcapasso
Classe II: divergência de opiniões
Classe III: consenso geral contra o uso do marcapasso
Essa classificação também é modificada pelas considerações acerca de cada paciente: se ele vive sozinho, dirige veículos, vive em uma área com atenção médica inacessível, requer tratamento farmacológico concomitante que, reconhecidamente, suprime o ritmo cardíaco, ou tem outras condições cardiovasculares que poderiam ser agravadas pela freqüência cardíaca lenta. A maioria dos pacientes com bloqueio cardíaco com provado é classificada no grupo I, enquanto que os indivíduos com bradicardia assintomática ficam no grupo III. A comprovação gráfica da arritmia deletéria passou a ter importância crítica. Embora a maioria dos médicos esteja mais preocupada em prescrever aquilo que eles acreditam ser melhor para seus pacientes, é essencial reconhecer que atualmente existem restrições fiscais, através das orientações recentemente propostas pelo Health Care Finance Administration (HCFA), que supervisiona os programas de reembolso do Medicare. Em vigor a partir de 1º de setembro de 1986, a aprovação prévia (pré-hospitalar, pré -procedimento) precisa ser obtida por telefone, seguida da autorização escrita para qualquer procedimento de marcapasso, em todos os pacientes com idade incluída no Medicare. Embora os critérios relacionados a seguir sejam suficientemente amplos para incluir a maioria dos pacientes, o médico que implanta tais dispositivos precisa certificar-se de que a documentação adequada seja apresentada no prontuário hospitalar, em todos esses pacientes. Atualmente, os registros de todos os pacientes com idades incluídas no Medicare estão sendo revisados para a presença dessa documentação.
Se o objetivo do marcapasso for simplesmente corrigir a bradicardia, sem se preocupar com o impacto sobre o débito cardíaco, então poderá ser suficiente um sistema de estimulação ventricular de câmara única; quando se desejar, além da supressão da bradicardia, um aumento do débito cardíaco, um sistema de marcapasso de câmaras duplas é conveniente para recuperar a função do transporte atrial. Na ausência de contração atrial significativa, um dispositivo de freqüência variável que responda ao estresse, através do sensor alternado, pode ser escolhido. Em geral, o esquema seguido em nossa instituição está ilustrado na Fig. 9-46. Ele é modificado em cada caso, de acordo com as variáveis semelhantes às propostas pelas orientações da AHA/ACC, mais as considerações locais do uso do marcapasso na área domiciliar do paciente.
Orientações Aprovadas pelo Medicare para a Implantação do Marcapasso Permanente
Em virtude das preocupações acerca da conveniência de algumas implantações de marcapassos realizadas nos últimos anos, aliada aos custos crescentes dessa tecnologia em uma época em que a restrição de gastos com a assistência médica tomou-se uma exigência política e social, a HCFA publicou orientações para a realização desses procedimentos (Quadros 9-4 e 9-5). 158 Elas também determinam que a aprovação pré-internação e pré -procedimento seja proporcionada pela Physician's Review Organization local.37 O reconhecimento da extrema variabilidade na apresentação dos pacientes, combinações de processos patológicos e sutilezas da interação entre as disfunções fixas ou intermitentes do sistema de condução e a doença atual ou a medicação necessária, não é surpreendente para que os médicos considerem onerosa essa "receita de bolo" para prescrição de marcapassos. Apesar das falhas e inconsistências evidentes nas orientações existentes, o médico que prescreve tais dispositivos deve estar familiarizado com elas, já que elas ainda constituem a base para o reembolso do hospital e/ou médico.
Vigilância do Marcapasso
É impossível estabelecer um esquema de acompanhamento que assegure a detecção precisa de todos os casos de disfunção do marcapasso, embora seja prático segundo considerações sobre o estilo de vida do paciente. Uma abordagem tridimensional, que combina o contato médico-paciente direto em uma clínica de marcapasso ou consultório particular com a auto-avaliação pelo paciente, resguardada por um esquema de telemetria telefônica, detectará 95% dos casos de disfunção do marcapasso. Os 5% restantes incluem fraturas repentinas dos cabos e disfunções imprevisíveis dos componentes, para as quais nenhum sistema de vigilância será totalmente eficaz. Os princípios de avaliação do consultório ou clínica estão ilustrados no Quadro 9-6. O esquema das consultas médicas do paciente deve variar de acordo com os problemas clínicos concomitantes do paciente e a utilização de métodos alternativos de vigilância. Muitos pacientes idosos com insuficiência cardíaca, diabetes melito ou debilidade geral concomitante podem precisar de acompanhamento a cada 3 a 4 meses, enquanto outros, cuja função do marcapasso está sendo monitorizada por telefone, podem ser examinados anualmente, ou duas vezes ao ano. A história do rendimento do marcapasso em outros pacientes ajuda a estabelecer a freqüência desejável do acompanhamento. Portanto, as unidades com maior probabilidade de falência precoce, como certos aparelhos "revogados", podem precisar ser acompanhadas com mais cuidado. Embora cada paciente deva ser tratado individualmente, um esquema para os sistemas alimentados por lítio, utilizando uma combinação de visitas diretas e telemetria telefônica, que é adequado para muitos pacientes, é semanal durante as 6 semanas que se seguem à implantação, a fim de estabelecer a função confiável do eletrodo e, a partir daí, a cada 6 meses com vigilância 2 vezes ao mês.
O entusiasmo e o interesse da equipe de monitorização são determinantes importantes da qualidade do acompanhamento. Suas perguntas acerca da saúde geral do paciente, se existe evidência de irritação cutânea localizada em torno do dispositivo implantado, ou sobre a resposta do paciente aos artigos na imprensa leiga, são freqüentemente mais importantes durante a telemetria telefônica do que apenas o ECG transmitido. Se o paciente estiver emocionalmente estável, deve-se solicitar sua colaboração na " auto- avaliação" para sinais de problema instalado ou iminente. Isso inclui o exame periódico da área do implante, para sinais de ruptura cutânea potencial e uma checagem diária do pulso (nos pacientes cujo ritmo cardíaco for predominantemente estimulado).
Finalmente, o verdadeiro defensor do marcapasso precisa manifestar integridade na prescrição dos dispositivos de estimulação, atenção meticulosa para os detalhes na realização do procedimento e avaliação metódica durante o acompanhamento. Em condições ideais, tais profissionais devem procurar filiar-se à North American Society of Pacing and Electrophysiology.***** Na época em que este artigo foi escrito, não existiam normas oficiais estabelecidas para os indivíduos que escolheram a função de implantar marcapassos, embora tenham sido feitas recomendações para que esses indivíduos realizem, no mínimo, 25 implantações primárias e 15 trocas ou revisões de geradores, durante um programa de treinamento formal.68
Agradecimentos
O autor responsável agradece, reconhecidamente, as contribuições e progressos consideráveis na compreensão da tecnologia da estimulação cardíaca, em todas as suas várias manifestações que têm sido possibilitadas pelos treinandos em cardiologia precedentes e atuais, incluindo-se os dois co-autores atuais; co-autores antigos desse capítulo, assim como vários técnicos de laboratórios de marcapasso que, freqüentemente, se mostraram mais argutos do que seus correspondentes médicos. Esses indivíduos incluem, porém não se limitam aos seguintes: Drs. John C. McDermott, Frederick K. Poulin, Donald A. Rediker, Stantey Schneller, Mark Schoenfeld, Ellen Jansyn. A equipe técnica incluiu a Sr Karen (Peterson) Kolbjornson, Srtª Karen Longmuir, Srª Susan Manna e Srtª Rose Guanci.
Notas
*Pacesetter Inc., Sylmar, Califórnia.
**Telectronics PASAR e Intermedics INTERTACH.
***Parsonnet Pouch, United States Catheter and Instrument Co.: catálogo nº 002906.
**** Um rádio transistorizado AM ajustado para 550 kHz e colocado sobre o gerador do marcapasso transmitirá uma série de batimentos coincidentes com os estímulos do dispositivo. Isso simplesmente confirma a emissão de um estímulo. Nos pacientes cujos marcapassos estão inibidos pela atividade cardíaca cridogena, a aplicação de um ímã combinada à radioausculta possibilita a confirmação do intervalo de estimulação do marcapasso, embora seja necessário um exame mais sofisticado para confirmar a sensibilidade e captura confiáveis.
***** North American Society of Pacing and Electrophysiology (NASPE 13 Eaton Court, Wellesley Hills, Mass. 02181).
Referências
1. Akhtar, M. Retrograde conduction in man. P.A.C.E. 4:548, 1981.
2. Alicandri, C., Fouad, F. M., Tarazi, R. C., et al. Three cases of hypotension and syncope with ventricular pacing: Possible role of atrial reflexes. Am. J. Cardiol. 42:137, 1978.
3. Anderson, K., Humeri, D., Klein, G. J., et al. A rate variable pacemaker which automatically adjusts for physical activity (Abstract #44). P.A.C.E. 6:A-12, 1983.
4. Aristotle. The Works. Translated under the ed. of J. A. Smith and W. D. Ross. Oxford: Clarendon, 1913.
5. Barold, S. S., Gaidula, J. J., and Castillo, R. Unusual response of demand pacemakers to magnets.Br. Heart J. 35:353, 1973.
6. Barold, S. S., Ong, L. S., Folkoff, M. D., et al. Inhibition of bipolar demand pacemaker by diaphragmatic myopotentials. Circulation 56:679, 1977.
7. Bayliss, C. E., Bearlands, D. S., and Baird, R. J. The pacemaker twiddlers syndrome. Circulation . J. 99:371, 1968.
8. Beard, G. M., and Rockwell, A. D. On the Medical and Surgical Uses of Electricity (8th ed.). New York: Wood, 1891.
9. Benchimol, A., Li, Y., and Dimond, E. G. Cardiovascular dynamics in complete heart block at various heart rates: Effect of exercise at a fixed heart rate. Circulation 30:542, 1964.
10. Bidder, F Ober functionell verschiedene und räumlich getrennte Nervencentra in Froschherzen. Arch. f Anat. Physiol. 20:163, 1852.
11. Bigelow, W. A., Callaghan, J. C., and Hopps, J. A. General hypothermia for experimental intracardiac Surgery. Ann. Surg. 132:531, 1950.
12. Bilitch, M., Cosby, R. S., and Cafferky, E. A. Ventricular fibrillation and competitive pacing. N. Engl. J. Med. 276:598, 1967.
13. Bing, o. H. L., McDowell, J. W., Hantman, J., et al. Pacemaker placement by electrocardiographic monitoring. N. Engl. J. Med. 287:651, 1972.
14. Birch, G. E., and DePasquale, N. P. A History of Electrocardiography. Chicago: Year Book, 1964.
15. Braunwald, N. S., Morrow, A. G., Debroske, J. M. F., et al. Accelerated fatigue testing of available pacemaker electrodes and Elgiloy wire coils. Surgery 58:846, 1965.
16. Brenner, A. S., Wagner, G. S., Anderson, S. T., et al. Transvenous, transmediastinal and transthoracic ventricular pacing. Circulation 49:407, 1974.
17. Brockman, S. K. Cardiodynamics of complete heart block. Am. J. Cardiol. 16:72, 1965.
18. Brownlee, R. R., Shimmel-Gordon, J. B., DelMarco, C., et al. A new symbolic language for diagramming pacemaker/heart interaction. P.A.C.E. 5:700, 1982.
19. Cammilli, L., Alcidi, L., and Papeschi, G. A New Pacemaker Autoregulating the Rate of Pacing in Relation to the Metabolic Needs. In Y. Watanabe (ed.), Cardiac Pacing. Amsterdam: Excerpta Medica, 1977. P. 414.
20. Castellanos, A., Jr., Lemberg, L., and Berkovits, B. V. The "demand" cardiac pacemaker: A new instrument for the treatment of A-V conduction disturbances. Presented at Inter-American College of Cardiology Meeting, Montreal, Canada, June 1964.
21. Chamberlain, D. A., Leinbach, R. C., Vassaux, C. E., et al. Sequential atrioventricular pacing in heart block complicating acute myocardial infarction. N. Engl. J. Med. 282:577, 1970.
22. Chardack, W. M., Gage, A. A., and Greatbatch, W. A transistorized, self-contained, implantable pacemaker for the long term correction of complete heart block. Surgery 48:643, 1960.
23. Chauvreau, A. Inscription électrique des mouvements valvulaires qui déterminent l'ouverture et l'occlusion des orifices du coeur. J. Physiol. Pathol. Gen. 1:377, 1899.
24. Cohn, J. D., and Thorson, R. F. Extrusion of pacemaker pulse generator due to design defect. J. Thorac. Cardiovasc. Surg. 65:323, 1973.
25. Crystal, R. G., Kastor, J. A., and DeSanctis, R. W. Inhibition of discharge of an external demand pacemaker by an electric razor. Am. J. Cardiol. 27:695, 1971.
26. Cywinski, J., Cooper, J., and Hahn, A. Biogalvanic Power Sources. In H. J. T. Thalen (ed.), Proceedings of the IVth International Symposium on Cardiac Pacing, Groningen, 1973. Assen, Netherlands: Royal Van Gorcum, 1974. P. 216.
27. Cywinski, J., Hahn, A., and Easley, J. Performance of Implanted Biogalvanic Pacemakers. In Y. Watanabe (ed.), Proceedings of the Vth International Symposium on Cardiac Pacing, Tokyo, 1976. Amsterdam: Excerpta Medica, 1977. P. 447.
28. Dargan, E. L., and Norman, J. C. Conservative management of infected pacemaker pulse generator sites. Ann. Thorac. Surg. 12:297, 197 1.
29. Debney, D. J. Cardiac pacemaker encapsulation investigation. Biomed. Eng. 6:458, 1971.
30. DeSanctis, R. W. Diagnostic and therapeutic uses of atrial pacing. Circulation 43:748, 197 1.
31. DiCola, V. C., Hand, R., Boucher, C. A., et al. Exercise cardiopulmonary assessment with dual chamber pacing versus ventricular pacing. P.A.C.E. 6:A-81, 1983.
32. Dreifus, L. S., Satinsky, J. D., Moghadam, K., et al. Pharmacological and Electrical Control of Arrhythmias: In H. 1. Russek (ed.), Cardiovascular Problems: Perspectives and Progress. Baltimore: University Park, 1974. P. 331.
33. Duchenne, G. B. A. De I'Électrisation Localisée et de son Application à la Pathologie et à la Therapeutique par Courants Galvanique Interrompus et Continus (3rd ed.). Paris: Baillière 1872.
34. Eagle, K., Mulley, A. G., Singer, D. E., et al. Single and dual chamber cardiac pacemakers: A formal cost comparison. Ann. Intern. Med. 105: 264, 1986.
35. Ebbell, B. The Ebers Papyrus. Copenhagen: Levin & Munksgaard, 1937.
36. Elmqvist, R., and Senning, A. An Implantable Pacemaker for the Heart. In Proceedings of the Second International Conference on Medical Electronics 253, London: Iliffe, 1960.
37. EMPSRO PRO Medicare General Memorandum #84-11, Dec. 10, 1984.
38. Enger, C. C., and Kennedy, J. H. Piezoelectric power sources utilizing the mechanical energy of the human heart. Conf. Engin. Med. Biol. 16:60, 1962.
39. Erlanger, J. On the physiology of heartblock in mammals with especial reference to the causation of Stokes-Adams disease. J. Exp. Med. 7:676, 1905; 8:8, 1906.
40. Erlebacher, J. A., Donner, R. L., and Stelzer, P. E. Hypotension with ventricular pacing: An atrial vasodepressor reflex in human beings. J. Am. Coll. Cardiol. 4:550, 1984.
41. Escher, D. J. W., Schwedel, J. B., Eisenberg, R., et al. Cardiovascular dynamic responses to artificial pacing in patients in heart block. Circulation 24:928, 1961.
42. Fester, K., and Doty, R. L. Solid state batteries for cardiac pacemakers. Med. Instrum. 7:172, 1973.
43. Fields, J., Berkovits, B. V., and Matloff, J. M. Surgical experience with temporary and permanent A-V sequential demand pacing. J. Thorac. Cardiovasc. Surg. 66:865, 1973.
44. Fischell, R. A study of radiation exposure of patients with nuclear pacemakers. Presented at the First European Symposium on Cardiac Pacing, London,1978.
45. Fisher, J., and Furman, S. Implantable automatic burst pacemaker for the termination of ventricular tachycardia (Abstract). Am. J. Cardiol. 45:458, 1980.
46. Floresco, N. Pince excitatrice. J. Physiol. Pathol. Gen. 7:785, 1905.
47. Floyer, Sir J. The Physician's Pulse Watch. London: Smith & Walford, 1707.
48. Folkman, M. J., and Watkins, E., Jr. An artificial conduction system for the management of experimental complete heart block. Surg. Forum 8:33 1, 1958.
49. Frye, R. L., et al. Guidelines for permanent pacemaker implantation. J. Am. Coll. Cardiol. 4:434, 1984.
50. Furman, S., and Cooper, J. A. Atrial fibrillation during A-V sequential pacing. P.A.C.E. 5:133, 1982.
51. Furman, R. W., Hiller, A. K., Playforth, R. W., et al. Infected permanent cardiac pacemaker: Management without removal. Ann. Thorac. Surg. 14:54, 1972.
52. Furman, S., Hurzeler, P., and De Caprio, V. Cardiac Pacing and pacemakers: 111. Sensing the cardiac electrogram. Am. Heart J. 93:794, 1977.
53. Furman, S., Hurzeler, P., and DeCaprio, V. The ventricular endocardial electrogram and pacemaker sensing. J. Thorac. Cardiov. Surg. 73:258, 1977.
54. Furman, S., and Robinson, G. The use of an intracardiac pacemaker in the correction of total heart block. Surg. Forum 9:245, 1958.
55. Galenus. Opera Omnia. Translated by C. G. Kuehn. Leipzig: Cnobloch, 1821-1833.
56. Gaskell, W. H. On the rhythm of the heart of the frog and on the nature of the action of the vagus nerve. Philos. Trans. R. Soc. Lond. 173:993, 1882.
57. Gaskell, W. H. On the innervation of the heart with special reference to the heart of the tortoise: J. Physiol. 4:43, 1883.
58. Gilmore, J. P., Sarnoff, S. J., and Mitchell, J. H. Synchronicity of ventricular contraction: Observations comparing hemodynamic effects of atrial and ventricular pacing. Br. Heart J. 25:299, 1963.
59. Glenn, W. W. L., Hageman, J. H., Mauro, A., et al. Electrical stimulation of excitable tissue by radio-frequency transmission. Ann. Surg. 160:338, 1964.
60. Godinko, N., cited by Schechter, D. C. Origins of electrotherapy. N.Y. State J. Med. 71:1114, 197 1.
61. Haas, J. M., and Strait, G. B. Pace maker- induced cardiovascular failure: Hemodynamic and angiographic observations. Am. J. Cardiol. 33:295, 1974.
62. Harris, A. Pacemaker "heart sound." Br. Heart J. 29:608, 1967.
63. Harthorne, J. W. Prognostic Determinants of Late Survival in Patients with Cardiac Pacemakers. In Y. Watanabe (ed.), Proceedings of the 5th International Symposium on Cardiac Pacing. Tokyo: Excerpta Medica, 1977. P. 271.
64. Harthorne, J. W. Cardiac Pacing. In T. O. Cheng (ed.), The International Textbook of Cardiology. New York: Pergamon, 1986.
65. Harthorne, J. W. Indications for pacemakers. Prog. Cardiovasc. Dis. 23:393, 1981.
66. Harthorne, J. W., Eisenhauer, A. C., and Steinhaus, D. M. Pacemaker mediated tachycardias: An unresolved problem. P.A.C.E. 7:1140, 1984.
67. Harthorne, J. W., McDermott, J., and Peterson, K. B. Who Should Implant a Pacemaker System, Cardiologist or Surgeon? In H. J. Th. Thalen and J. W. Harthorne (eds.), To Pace or Not to Pace: Controversial Subjects on Cardiac Pacing. The Hague: Martinus Nijhoff, 1978. P. 263.
68. Harthorne, J. W., and Parsonnet, V. Task Force VI: Training in Cardiac Pacing, The Bethesda Conference. J. Am. Coll. Cardiol. 7:1213, 1986.
69. Hartzler, G. O., Maloney, J. D., Curtis, J. J., et al. Hemodynamic benefits of atrioventricular sequential pacing after cardiac Surgery. Am. J. Cardiol. 40:232, 1977.
70. Harvey, W. The Circulation of the Blood and Other Writings. London: Dent, 1952.
71. Heinz, John (Chairman). Fraud, Waste, and Abuse in the Medicare Pacemaker Industry: An Information Paper-Special Committee on Aging (#98116-0). Washington, D.C.: Government Printing Office, 1982.
72. Hellerstein, H. K., and Liebow, I. M. Control of heart rate with an intracardiac thermode. J. Lab. Clin. Med. 35:703, 1949.
73. Hellerstein, H. K., Shaw, D., and Liebow, I. M. An extracorporal electronic by-pass of the A-V node. J. Lab. Clin. Med. 36:833, 1950.
74. His, W., Jr. Die Thätigkeit des embryonalen Herzens und deren Bedeutung für die Lehre von der Herzbewegung beim Erwachsensen. Arb. Med. Klin. (Leipzig) 14:49, 1893.
75. Huchard, H. Les formes frustes et associées de la maladie de Stokes Adams. Arch. Gen. Med. (Paris) 2:257, 1895.
76. Huchard, H. Traite Clinique des Maladies du Coeur et de l'Aorte (3rd ed.). Paris: Doin, 1899.
77. Hunter, S. W., Roth, N. A., Bernadez, D., et al. A bipolar myocardial electrode for complete heart block. Lancet 1:506, 1979.
78. Hyman, A. S. Resuscitation of the stopped heart by intracardiac therapy. Arch. Intern. Med. 46: 553, 1930.
79. Hyman, A. S. Resuscitation of the stopped heart by intracardiac therapy: Experimental use of an artificial pacemaker. II. Arch. Intern. Med. 50:283, 1932.
80. Jacoby, G. W., and Jacoby, J. R. Electricity in Medicine. Philadelphia: Blakiston, 1919.
81. Johnson, A. D., and Daily, P. D. Hypertrophic subaortic stenosis complicated by high degree heart block: Successful treatment with an atrial synchronous ventricular pacemaker. Chest 67:49 1, 1975.
82. Kahn, A., Morris, J. J., and Citron, P. Patientinitiated rapid atrial pacing to manage supraventricular tachycardia. Am. J. Cardiol. 38:200, 1976.
83. Kellaway, P. The part played by electric fish in the early history of bioelectricity and electrotherapy. Bull. Hist. Med. 20:112, 1946.
84. Kohman, G. T. Hermance, H. W., and Downes, G. H. Silver migration in electrical insulation. Bell System Tech. J. 34:1115, 1955.
85. Kossowsky, B. D., Scherlag, B. J. and Damato, A. N. Re-evaluation of the atrial contribution to ventricular function: Study using His bundle pacing. Am. J. Cardiol. 21:518, 1968.
86. Kruse, L, Arnman, K., Conradson, T. R., et al. A comparison of the acute and long term hemodynamic effects of ventricular inhibited and atrial synchronous ventricular inhibited pacing. Circulation 65:846, 1982.
87. Lasczovics, A., Schlick, W., Losert, U., et al. The use of central venous blood temperature (CVT) as a guide for rate control in pacemaker therapy. (Abstract #46). P.A.C.E. 6:12, 1983.
88. Leibowitz, J. O., and Ullman, D. T. Early references to heart block. J. Hist. Med. 20:43, 1965.
89. Leinbach, R. C., Chamberlain, D. A., Kastor, J. A., et al. A comparison of the hemodynamic effects of ventricular and sequential A-V pacing in patients with heart block. Am. Heart J. 78:502, 1969.
90. Lemberg, L. Castellanos, A., and Berkovitz, B. V. Pacemaking on demand in A-V block. J.A.M.A. 191:106, 1965.
91. Lillehei, R. C., Romero, L. H., Beckman, C. B., et al. A new solid-state, long-life, lithium-powered pulse generator. Ann. Thorac. Surg. 18:479, 1974.
92. MacWilliam, J. A. Fibrillar contraction of the heart. J. Physiol. 8:296, 1887.
93. MacWilliam, J. A. Electric stimulation of the mammalian heart. Tr. Int. M. Congr. 3:253, 1887.
94. Major, R. H. Classic Descriptions of Diseases. Springfield: Thomas, 1932.
95. Mansfield, P. B., and Cole, A. D. Biological and electrotechnical aspects of myocardial stimulation. Dig. 6th Int. Conf. Med. El. Biol. Eng. 89:1965.
96. Marmorstein, M. Contribution a I'étude des excitations électriques localisées sur le coeur en rapport avec la topographie de l'innervation du coeur chez le chien. J. Physiol. Pathol. Gen. 25:617, 1927.
97. Mirowsky, M., Reid, P. R., Mower, M. M., et al. Termination of malignant ventricular arrhythmias with an implanted automatic defibrillator. N. Engl. J. Med. 303:322, 1980.
98. Mitsui, T., Mizuno, A., Hasegawa, T., et al. Atrial rate as an indicator for optimal pacing rate and the pacemaking syndrome. Ann. Cardiol. Angeiol. (Paris) 20:371, 1972.
99. Morgagni, G. B. The Seats and Causes of Diseases Investigated by Anatomy. Translated by B. Alexander, London: Miller & Cadell, 1769.
100. Morgan, G., Ginks, W., Siddons, H., et al. Septicemia in patients with an endocardial pacemaker. Am. J. Cardiol. 44:221, 1979.
101. Musschenbroek, P. van. Introductio ad Philosophiam Naturalem. Leyden: Luchtmans, 1762.
102. Myers, G. H., Parsonett, V., Zucker, 1. R., et al. Biologically-energized cardiac pacemaker. IEEE Trans. Biomed. Eng. BME 10:83, 1963.
103. Nasrallah, A., Hall, R. J., Garcia, E., et al. Runaway pacemaker in seven patients: A persisting problem. J. Thorac. Cardiovasc. Surg. 69:365, 1975.
104. Nathan, D. A., Center, S., Chang-You-Wu, et al. An implantable synchronous pacemaker for the long term correction of complete heart block. Am. J. Cardiol. II-3:362, 1963.
105. Nathan, D. A., Center, S., Wu, C. Y., et al. An implantable, synchronous pacemaker for the long term correction of complete heart block. Circulation 27:682, 1963.
106. Nollet, J. A. Essai sur I'Électricite des Corps (3rd ed.). Paris: Guerin, 1754.
107. Ogawa, S., Dreifus, L. S., Shenoy, P. N., et al. Hemodynamic consequences of atrioventricular and ventriculoatrial pacing. P.A.C.E. 1:8, 1978.
108. Ovid. Pontic Epistles. In M. B. Strauss (ed.), Familiar Medical Quotations. Boston: Little, Brown, 1968.
109. Parsonnet, V. A stretch fabric pouch for implanted pacemakers. Arch. Surg. 105:654, 1972.
110. Parsonnet, V. Permanent pacing of the heart: A comment on technique. Am. J. Cardiol. 36:268, 1975.
111. Parsonnet, V. Pacemaker Implantation. In Blades Surgical Diseases of the Chest (4th ed.). St. Louis: Mosby, 1978. P. 750.
112. Parsonnet, V. Results of a national survey. Presented at the 6th International Symposium on Cardiac Pacing, Montreal, October 1979.
113. Parsonnet, V., Feldman, S., Parsonnet, J., et al. Arrhythmias induced by exercise in paced patients. Am. Heart J. 87:76, 1974.
114. Parsonnet, V., Furman, S., Smyth, N. P. D., et al. Optimal resources for implantable cardiac pacemakers. Circulation 68:227A, 1968.
115. Parsonnet, V., Myers, G. H., Zucker, 1. R., et al. A cardiac pacemaker using biologic energy sources. Trans. Am. Soc. Artif. Intern. Organs 9:174, 1963.
116. Parsonnet, V., Parsonnet, M., and Manhardt, M. Cardiac Pacing and pacemakers: VII. Power sources for implantable pacemakers. Part I. Am. Heart J. 94:517, 1977.
117. Patel, A. K., Yap, V. U., and Thomsen, J. H. Adverse effects of right ventricular pacing in a patient with aortic stenosis. Chest 72:103, 1977.
118. Policki, B. Cited by Schechter, D. C., Lillehei, C. W., and Soffer, A. History of sphygmology and heart block. Dis. Chest 55(Suppl I):I-534, 1969.
119. Pope. Cited by Schechter, D. C., Lillehei, C. W., and Soffer, A. History of sphygmology and heart block. Dis. Chest 55(Suppl I):I-534, 1969.
120. Preston, T. A. Anodal stimulation as a cause of pacemaker induced ventricular fibrillation. Am. Heart J. 86:366, 1973.
120a. Rediker, D. E., Eagle, K. E., Homma, S., et al. Clinical and hemodynamic comparison of VVI versus DDD pacing in patients with DDD pacemakers. Am. J. Cardiol. 61:323, 1988.
121. Remak, R. Neurologische Erlaüterungen. Arch. J. Anat. u. Physiol. 11:463, 1844.
122. Rickards, A. F., Donaldson, R. M., and Thalen, H. J. The use of QT interval to determine pacing rate: Early clinical experience. P.A.C.E. 6:346, 1983.
123. Rickards, A. F., and Norman, J. Relation between QT interval and heart rate: New design of physiologically adaptive cardiac pacemaker. Br. Heart J. 45:56, 1981.
124. Robinovitch, L. G. Resuscitation of a woman in profound syncope caused by chronic morphine poisoning; means used: rhythmic excitations with an induction current; the author's method and model of coil. J. Ment. Pathol. 8:179, 1907-1909.
125. Rossi, P., Plischi, G., Canducci, G. C., et al. The implantable respiratory dependent pacemaker: Clinical method for fitting individual metabolic need (Abstract #48). P.A.C.E. 6:A-13, 1983.
126. Roy, O. Z., and Wehnert, R. W. Keeping the heart alive with a biologic battery. Electronics 39:105, 1966.
127. Ruskin, J. W., Garan, H., Poulin, F., et al. Patient activated radiofrequency pacing for recurrent sustained ventricular tachycardia (Abstract). Presented at the VIth World Symposium on Cardiac Pacing, Montreal, October 1979.
128. Rustan, P. L., Hurt, W. D., and Mitchell, J. C. Microwave oven interference with cardiac pacemakers. Assoc. Adv. Med. Instrum. 7:185, 1973.
129. Samet, P., Bernstein, W. H., Nathan, D. A., et al. Atrial contribution to cardiac output in complete heart block. Am. J. Cardiol. 16:1, 1965.
130. Satinsky, V., Dreifus, L. S., Racine, P., et al. Cardiac Pacing by means of electrical energy derived directly from the heart. Surgery 60:600, 1966.
131. Schechter, D. C. Origins of electrotherapy. I. N.Y. State J. Med., May, 197 1. P. 997.
132. Schechter, D. C. Origins of electrotherapy. II. N. Y. State J. Med., May 197 1. P. 1114.
133. Schechter, D. C. Background of clinical cardiac electrostimulation: V. Direct electrostimulation of heart without thoracotomy. N.Y. State J. Med., 1972. P. 605.
134. Schechter, D. C. Background of clinical cardiac electrostimulation: VI. Precursor apparatus and events to the electrical treatment of complete heart block. N.Y. State J. Med., April 1972. P. 953.
135. Schechter, D. C. Background of clinical, cardiac electrostimulation: VII. Modern era of artificial cardiac pacemakers. N.Y. State J. Med., May 1972. P. 1166.
136. Schechter, D. C. Experimental replication of heart block. P.A.C.E. 1:269, 1978.
137. Schechter, D. C., Lillehei, C. W., and Soffer, A. History of sphygmology and heart block. Dis. Chest (Suppl I):I-534, 1969.
138. Schneider, A. A., and Kulp, J. W. The lithium iodine cell: A history. Med. Elec. Data 8:48, Jan.Feb. 1977.
139. Senning, A. Discussion. J. Thorac. Surg. 38:639, 1959.
140. Shapland, J. E., MacCarter, D., Tockman, B., et al. Physiologic benefits of rate responsiveness. P.A.C.E. 6:329, 1983.
141. Sirol, M. Galvan et le galvanisme: L'électricité animale. Thèse Fac. Mixte Med. Pharm. Toulouse, 1939.
142. Spens, T. History of a case in which there took place a remarkable slowness of the pulse. Med. Commentaries Decade 2 7:458, 1793.
143. Stannius, H. Versuche am Froschherzen. Arch. Anat. Physiol. U. Wiss. Med. 19:85, 1852.
144. Starmer, C. F., McIntosh, H. D., and Whalen, R. E. Electrical hazards and cardiovascular function. N. Engl. J. Med. 284:181, 1971.
145. Steiner, F. Über die Electropunctur des Herzens als Wiederbelebungsmittel in der Chloroformsyncope. Arch. Klin. Chir. 12:741, 1871.
146. Stewart, W. J., DiCola, V. C., Steinhaus, D., et al. Beat to beat changes in stroke volume between ventricular and dual chamber pacing: assessment with Doppler echocardiography. Circulation 68: 111-241, 1983.
147. Stokes, W. Observations on some cases of permanently slow pulse. Dublin Q. J. Med. Sci. 2:73, 1846.
148. Stone, J. M., Bhakta, R. D., and Lutgen, J. Dual chamber sequential pacing management of sinus node dysfunction: Advantages over single chamber pacing. Am. Heart J. 104:1319, 1982.
149. Stoney, W. S., Addlestone, R. B., Alford, W. C., Jr., et al. The incidence of venous thrombosis following long-term transvenous pacing. Ann. Thorac. Surg. 22:166, 1976.
150. Sutton, R., Morley, C., Chan, S. L., et al. Physiologic benefits of atrial synchrony in paced patients. P.A.C.E. 6:327, 1983.
151. Sweet, W. H. Stimulation of the sino-atrial node for cardiac arrest during operation. Bull. Am. Coll. Surg. 32:234, 1947.
152. Thalen, H. J. Th. Early History of Cardiac Pacing. In J. W. Harthorne and H. J. Th. Thalen (eds.), Boston Colloquium on Cardiac Pacing. The Hague: Martinus Nijhoff, 1972. P. 11.
153. Thalen, H. J. Th. Electrode Design and New Developments. In J. W. Harthorne and H. J. Th Thalen (eds.), Boston Colloquium on Cardiac Pacing. The Hague: Martinus, Nijhoff, 1977. P. 59.
154. Thevenet, A., Hodges, P. C., and Lillehei, C. W. The use of the myocardial electrode inserted percutaneously for control of complete atrioventricular block by an artificial pacemaker. Dis. Chest 34:621, 1958.
155. Thornton, A. W. Personal communication, 1979.
156. Tigerstedt, R. Ober die Bedeutung der Vorhöfe für die Rhythmik der Ventrikel des Saugethierherzens. Arch. J' Anat. u. Physiol. 497, 1884.
157. Tyers, G. F. O., Hughes, H. C., Brownlee, R. R., et al. Rechargeable silver modified mercuric oxidezinc cell for cardiac pacemakers. Am. J. Cardiol. 38:607, 1976.
158. U.S. Congress, Senate Consolidated Omnibus Budget Reconciliation Act 1985, P. L. 99272, 99th Congress, 2nd session, 1986.
159. Van Mechelen, R., and Hagemeijer, F Atrioventricular and Ventriculoatrial Conduction in Patients with Symptomatic Sinus Node Dysfunction. In Cardiac Pacing: Proceedings of' the 7th World Symposium on Cardiac Pacing. Darmstadt, FRG: Steinkopff- Verlag, 1983.
160. Volta, A. On the electricity excited by the mere contact of conducting substances of different kinds. Phil. Tri. 403, 1800.
161. Waldo, A. L., MacLean, W. A. H., Karp, R. B., et al. Entrainment and interruption of atrial flutter with atrial pacing. Circulation 56:737, 1977.
162. Waldo, A. L., MacLe W. A. H., Kays, R. B., et al. Continuous rapid atrial pacing to control recurrent or sustained supraventricular tachycardias following open heart Surgery. Circulation 54:245, 1976.
163. Walshe, W. H. A Practical Treatise on the Disease of the Heart and Great Vessels. Philadelphia: Blanchard and Lea, 1862.
164. Ward, D. E., Camm, A. J., Gainsborough, J., et al. Autodecremental pacing: A microprocessor based modality for the termination of paroxysmal tachycardias. P.A.C.E. 3:178, 1980.
165. Weber, E. F., and Weber, E. H. Experimenta quibus probatur nervos vagos rotatione machinae galvano-magneticae irritaos, motum cordis retardare et adeo intercipere. Ann. Univ. de Med. (Milan) 116:227, 1845.
166. Weirich, W. L., Gott, V. L., and Lillehei, C. W. The treatment of complete heart block by the combined use of myocardial electrode and an artificial pacemaker. Surg. Forum 8:360, 1957.
167. Wickham, G. Lithium anode pacemaker power source. Med. Elec. Data 7:46, 1976.
168. Wirtzfeld, A., Stange, K., Heinze, R., et al. An optical sensor for monitoring mixed venous oxygen saturation for an implantable rate-responsive pacing system (Abstract #47). P.A.C.E. 6:A-12, 1983.
169. Wooldridge, L. C. Uber die Funktion der Kammernerven des Saugetierherzens. Arch. J' Anal. u. Physiol. p. 522, 1883.
170. Yatteau, R. F. Radar-induced failure of a demand pacemaker. N. Engl. J. Med. 283:1447, 1970.
171 . Zoll, P. M. Resuscitation of the heart in ventricular standstill by external electric stimulation. N. Engl. J. Med. 247:768, 1952.
Copyright © 2000 eHealth Latin America